Biochemie van pijn: Alle pijnsyndromen hebben een ontstekingsprofiel. Een ontstekingsprofiel kan van persoon tot persoon verschillen en kan ook op verschillende momenten bij een persoon verschillen. De behandeling van pijnsyndromen is om dit ontstekingsprofiel te begrijpen. Pijnsyndromen worden medisch, operatief of beide behandeld. Het doel is om de productie van ontstekingsmediatoren te remmen / onderdrukken. En een succesvol resultaat is er een die resulteert in minder ontstekingen en natuurlijk minder pijn.
Inhoud
Biochemie van pijn
doelstellingen:
- Wie zijn de belangrijkste spelers
- Wat zijn de biochemische mechanismen?
- Wat zijn de gevolgen?
Ontsteking recensie:
Key Players
 Waarom doet mijn schouder pijn? Een overzicht van de neuroanatomische en biochemische basis van schouderpijn
Waarom doet mijn schouder pijn? Een overzicht van de neuroanatomische en biochemische basis van schouderpijn
SAMENVATTING
Als een patiënt vraagt Waarom doet mijn schouder pijn? , gaat het gesprek al snel over op wetenschappelijke theorie en soms op ongefundeerde vermoedens. Vaak wordt de clinicus zich bewust van de grenzen van de wetenschappelijke basis van hun uitleg, wat de onvolledigheid van ons begrip van de aard van schouderpijn aantoont. Deze review volgt een systematische benadering om fundamentele vragen met betrekking tot schouderpijn te helpen beantwoorden, met als doel inzicht te verschaffen in toekomstig onderzoek en nieuwe methoden voor de behandeling van schouderpijn. We zullen de rollen onderzoeken van (1) de perifere receptoren, (2) perifere pijnverwerking of nociceptie , (3) het ruggenmerg, (4) de hersenen, (5) de locatie van receptoren in de schouder en (6) ) de neurale anatomie van de schouder. We bekijken ook hoe deze factoren kunnen bijdragen aan de variabiliteit in de klinische presentatie, de diagnose en de behandeling van schouderpijn. Op deze manier willen we een overzicht geven van de componenten van het perifere pijndetectiesysteem en centrale pijnverwerkingsmechanismen bij schouderpijn die interageren om klinische pijn te produceren.
INLEIDING: EEN ZEER BEKNOPTE GESCHIEDENIS VAN PIJNWETENSCHAP ESSENTIEEL VOOR KLINIERS
De aard van pijn in het algemeen is de afgelopen eeuw een onderwerp van veel controverse geweest. In de 17e eeuw stelde Descartes 'theorie1 dat de intensiteit van pijn direct verband hield met de hoeveelheid geassocieerd weefselletsel en dat pijn werd verwerkt in één duidelijk pad. Veel eerdere theorieën vertrouwden op deze zogenaamde dualistische Descartiaanse filosofie en zagen pijn als het gevolg van de stimulatie van een specifieke perifere pijnreceptor in de hersenen. In de 20e eeuw volgde een wetenschappelijke strijd tussen twee tegengestelde theorieën, namelijk specificiteitstheorie en patroontheorie. De Descartiaanse specificiteitstheorie zag pijn als een specifieke afzonderlijke modaliteit van sensorische input met haar eigen apparaat, terwijl de patroontheorie meende dat pijn het gevolg was van de intense stimulatie van niet-specifieke receptoren.2 In 1965, Wall en Melzack s 3 gate-theorie van pijn leverde bewijs voor een model waarin pijnperceptie werd gemoduleerd door zowel sensorische feedback als het centrale zenuwstelsel. Een andere enorme vooruitgang in de pijntheorie rond dezelfde tijd was de ontdekking van het specifieke werkingsmechanisme van de opioïden.4 Vervolgens hebben recente vorderingen in neuroimaging en moleculaire geneeskunde ons algemene begrip van pijn enorm uitgebreid.
Dus hoe verhoudt dit zich tot schouderpijn?�Schouderpijn is een veel voorkomend klinisch probleem, en een gedegen begrip van de manier waarop pijn door het lichaam wordt verwerkt, is essentieel voor de beste diagnose en behandeling van de pijn van een patiënt. Vooruitgang in onze kennis van pijnverwerking belooft de discrepantie tussen pathologie en de perceptie van pijn te verklaren, en kan ons ook helpen verklaren waarom bepaalde patiënten niet reageren op bepaalde behandelingen.
BASISGEBOUW BLOKKEN VAN PIJN
Perifere sensorische receptoren: de mechanoreceptor en de nociceptor
Er zijn talrijke soorten perifere sensorische receptoren aanwezig in het menselijke bewegingsapparaat. 5 Ze kunnen worden geclassificeerd op basis van hun functie (als mechanoreceptoren, thermoreceptoren of nociceptoren) of morfologie (vrije zenuwuiteinden of verschillende soorten ingekapselde receptoren) .5 De verschillende typen receptoren kunnen vervolgens verder worden onderverdeeld op basis van de aanwezigheid van bepaalde chemische markers. Er zijn bijvoorbeeld significante overlappingen tussen verschillende functionele klassen van receptoren
Perifere pijnverwerking: Nociceptie
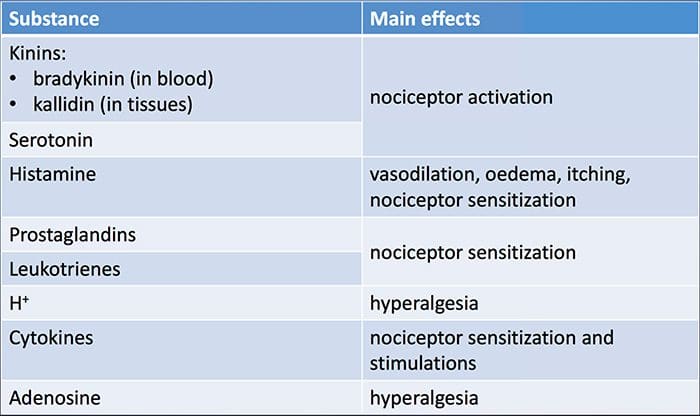
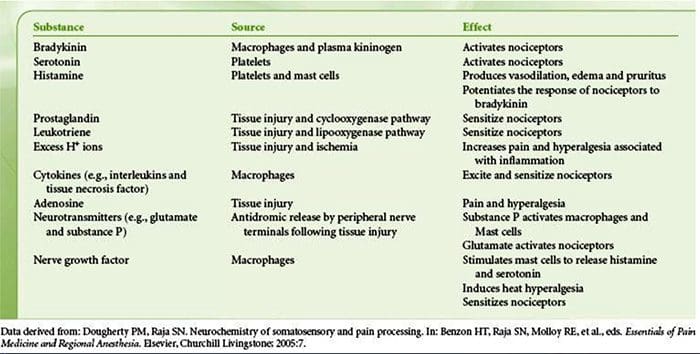
Bij weefselbeschadiging worden verschillende ontstekingsmediatoren door beschadigde cellen afgegeven, waaronder bradykinine, histamine, 5-hydroxytryptamine, ATP, stikstofmonoxide en bepaalde ionen (K + en H +). De activering van de arachidonzuurroute leidt tot de productie van prostaglandinen, tromboxanen en leukotriënen. Cytokinen, waaronder de interleukinen en tumornecrosefactor?, En neurotrofinen, zoals zenuwgroeifactor (NGF), komen ook vrij en zijn nauw betrokken bij het vergemakkelijken van ontstekingen.15 Andere stoffen zoals exciterende aminozuren (glutamaat) en opioïden ( endotheline-1) zijn ook betrokken bij de acute ontstekingsreactie.16 17 Sommige van deze middelen kunnen direct nociceptoren activeren, terwijl andere de rekrutering van andere cellen bewerkstelligen die vervolgens verdere faciliterende middelen afgeven.18 Dit lokale proces resulteert in een verhoogde responsiviteit. van nociceptieve neuronen op hun normale input en / of de rekrutering van een reactie op normaal subthreshold-inputs wordt perifere sensibilisatie genoemd. Figuur 1 vat enkele van de belangrijkste betrokken mechanismen samen.
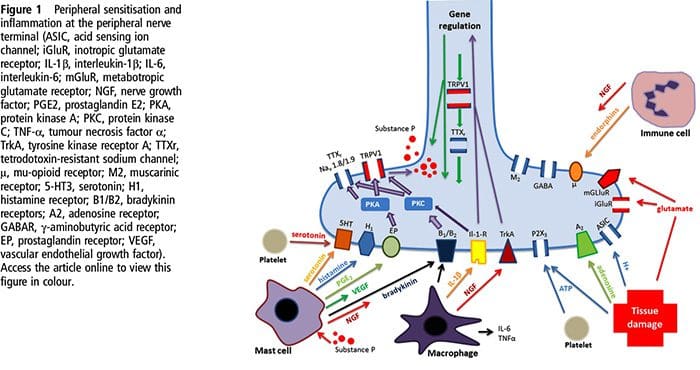 NGF en de transiënte receptor-potentiële kationkanaalsubfamilie V lid 1 (TRPV1) -receptor hebben een symbiotische relatie als het gaat om ontsteking en nociceptorsensibilisatie. De cytokinen die in ontstoken weefsel worden geproduceerd, zorgen voor een toename van de NGF-productie.19 NGF stimuleert de afgifte van histamine en serotonine (5-HT3) door mestcellen en sensibiliseert ook nociceptoren, waardoor mogelijk de eigenschappen van A? vezels zodat een groter deel nociceptief wordt. De TRPV1-receptor is aanwezig in een subpopulatie van primaire afferente vezels en wordt geactiveerd door capsaïcine, warmte en protonen. De TRPV1-receptor wordt gesynthetiseerd in het cellichaam van de afferente vezel en wordt getransporteerd naar zowel de perifere als centrale terminals, waar hij bijdraagt aan de gevoeligheid van nociceptieve afferente stoffen. Ontsteking resulteert in perifere NGF-productie die vervolgens bindt aan de tyrosinekinasereceptor type 1-receptor op de nociceptor-uiteinden, NGF wordt vervolgens getransporteerd naar het cellichaam waar het leidt tot een opwaartse regulatie van TRPV1-transcriptie en bijgevolg een verhoogde nociceptorgevoeligheid.19 20 NGF en andere ontstekingsmediatoren sensibiliseren TRPV1 ook via een diverse reeks secundaire boodschapperroutes. Van veel andere receptoren, waaronder cholinerge receptoren, β-aminoboterzuur (GABA) -receptoren en somatostatinereceptoren, wordt aangenomen dat ze ook betrokken zijn bij de perifere nociceptorgevoeligheid.
NGF en de transiënte receptor-potentiële kationkanaalsubfamilie V lid 1 (TRPV1) -receptor hebben een symbiotische relatie als het gaat om ontsteking en nociceptorsensibilisatie. De cytokinen die in ontstoken weefsel worden geproduceerd, zorgen voor een toename van de NGF-productie.19 NGF stimuleert de afgifte van histamine en serotonine (5-HT3) door mestcellen en sensibiliseert ook nociceptoren, waardoor mogelijk de eigenschappen van A? vezels zodat een groter deel nociceptief wordt. De TRPV1-receptor is aanwezig in een subpopulatie van primaire afferente vezels en wordt geactiveerd door capsaïcine, warmte en protonen. De TRPV1-receptor wordt gesynthetiseerd in het cellichaam van de afferente vezel en wordt getransporteerd naar zowel de perifere als centrale terminals, waar hij bijdraagt aan de gevoeligheid van nociceptieve afferente stoffen. Ontsteking resulteert in perifere NGF-productie die vervolgens bindt aan de tyrosinekinasereceptor type 1-receptor op de nociceptor-uiteinden, NGF wordt vervolgens getransporteerd naar het cellichaam waar het leidt tot een opwaartse regulatie van TRPV1-transcriptie en bijgevolg een verhoogde nociceptorgevoeligheid.19 20 NGF en andere ontstekingsmediatoren sensibiliseren TRPV1 ook via een diverse reeks secundaire boodschapperroutes. Van veel andere receptoren, waaronder cholinerge receptoren, β-aminoboterzuur (GABA) -receptoren en somatostatinereceptoren, wordt aangenomen dat ze ook betrokken zijn bij de perifere nociceptorgevoeligheid.
Een groot aantal ontstekingsmediatoren is specifiek betrokken bij schouderpijn en rotatormanchetziekte.21 Hoewel sommige chemische mediatoren de nociceptoren direct activeren, leiden de meeste tot veranderingen in het sensorische neuron zelf in plaats van het direct te activeren. Deze veranderingen kunnen afhankelijk zijn van vroege post-translationele of vertraagde transcriptie. Voorbeelden van de eerste zijn veranderingen in de TRPV25-receptor of in spanningsafhankelijke ionenkanalen als gevolg van de fosforylering van membraangebonden eiwitten. Voorbeelden van de laatste zijn de door NGF geïnduceerde toename van de TRV1-kanaalproductie en de door calcium geïnduceerde activering van intracellulaire transcriptiefactoren.
Moleculaire mechanismen van nociceptie
Het gevoel van pijn waarschuwt ons voor echt of dreigend letsel en triggert passende beschermende reacties. Helaas overleeft pijn vaak zijn nut als waarschuwingssysteem en wordt in plaats daarvan chronisch en slopend. Deze overgang naar een chronische fase brengt veranderingen in het ruggenmerg en de hersenen met zich mee, maar er is ook een opmerkelijke modulatie waarbij pijnboodschappen worden geïnitieerd - op het niveau van het primaire sensorische neuron. Inspanningen om te bepalen hoe deze neuronen pijnproducerende stimuli van thermische, mechanische of chemische aard detecteren, hebben nieuwe signaleringsmechanismen onthuld en ons dichter bij het begrip gebracht van de moleculaire gebeurtenissen die overgangen van acute naar aanhoudende pijn vergemakkelijken.
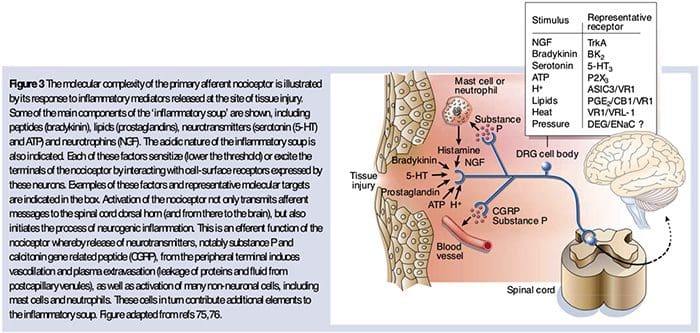 De neurochemie van nociceptoren
De neurochemie van nociceptoren
Glutamaat is de overheersende exciterende neurotransmitter in alle nociceptoren. Histochemische studies van volwassen DRG onthullen echter twee brede klassen van ongemyeliniseerde C-vezels.
Chemische transducers om de pijn erger te maken
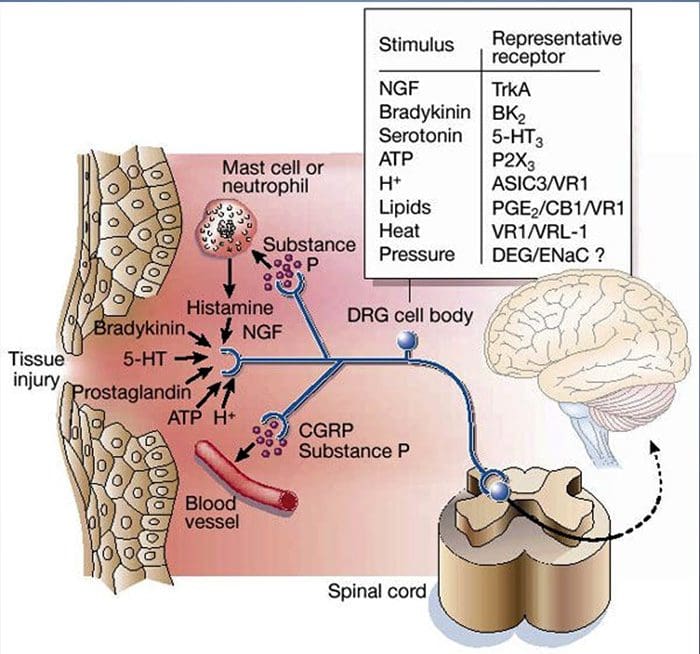
Zoals hierboven beschreven, verhoogt letsel onze pijnervaring door de gevoeligheid van nociceptoren voor zowel thermische als mechanische stimuli te verhogen. Dit fenomeen is gedeeltelijk het gevolg van de productie en afgifte van chemische bemiddelaars uit het primaire sensorische uiteinde en uit niet-neurale cellen (bijvoorbeeld fibroblasten, mestcellen, neutrofielen en bloedplaatjes) in de omgeving 36 (afbeelding 3). Sommige componenten van de ontstekingssoep (bijvoorbeeld protonen, ATP, serotonine of lipiden) kunnen de neuronale prikkelbaarheid direct veranderen door interactie met ionkanalen op het nociceptoroppervlak, terwijl andere (bijvoorbeeld bradykinine en NGF) binden aan metabotropische receptoren en bemiddelen hun effecten via second-messenger signalerende cascades11. Er is aanzienlijke vooruitgang geboekt bij het begrijpen van de biochemische basis van dergelijke modulerende mechanismen.
Extracellulaire protonen en weefselacidose
Lokale weefselacidose is een kenmerkende fysiologische reactie op verwonding en de mate van bijbehorende pijn of ongemak is goed gecorreleerd met de grootte van verzuring37. Toepassing van zuur (pH 5) op de huid produceert langdurige ontladingen in een derde of meer van polymodale nociceptoren die het ontvangende veld 20 innerveren.
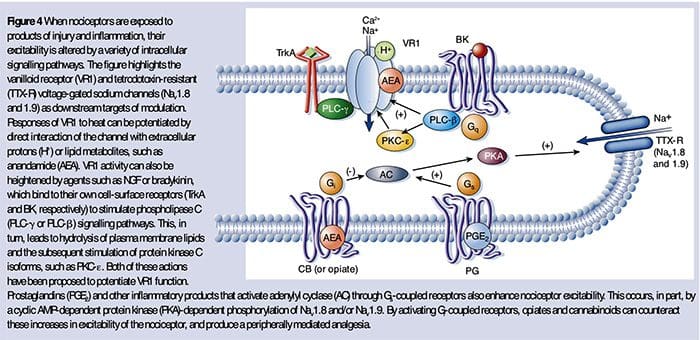 Cellulaire en moleculaire pijnmechanismen
Cellulaire en moleculaire pijnmechanismen
Abstract
Het zenuwstelsel detecteert en interpreteert een breed scala aan thermische en mechanische stimuli, evenals milieu- en endogene chemische irriterende stoffen. Wanneer ze intens zijn, genereren deze stimuli acute pijn en bij het vaststellen van aanhoudende schade vertonen zowel componenten van het perifere als het centrale zenuwstelsel van de pijntransmissieweg een enorme plasticiteit, verbeteren ze pijnsignalen en produceren ze overgevoeligheid. Wanneer plasticiteit beschermende reflexen mogelijk maakt, kan het gunstig zijn, maar als de veranderingen aanhouden, kan dit leiden tot een chronische pijnaandoening. Genetische, elektrofysiologische en farmacologische studies lichten de moleculaire mechanismen toe die ten grondslag liggen aan detectie, codering en modulatie van schadelijke stimuli die pijn veroorzaken.
Inleiding: Acute versus persistente pijn
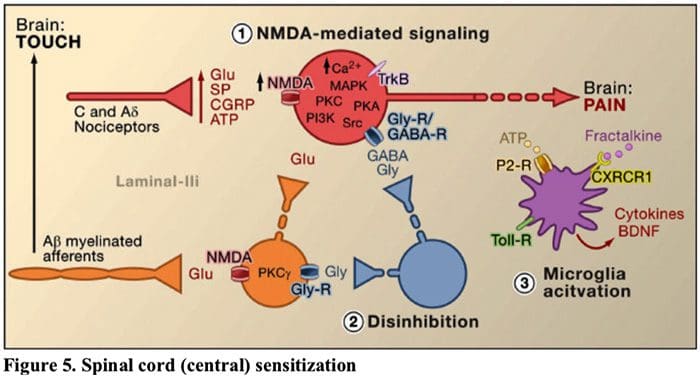 Figuur 5. Ruggenmerg (centraal) Sensibilisatie
Figuur 5. Ruggenmerg (centraal) Sensibilisatie
- Door glutamaat / NMDA-receptor gemedieerde sensibilisatie.�Na intense stimulatie of aanhoudend letsel, geactiveerde C en A? nociceptoren geven een verscheidenheid aan neurotransmitters af, waaronder dlutamaat, substantie P, calcitonine-gengerelateerd peptide (CGRP) en ATP, op outputneuronen in lamina I van de oppervlakkige dorsale hoorn (rood). Dientengevolge kunnen normaal gesproken stille NMDA-glutamaatreceptoren die zich in het postsynaptische neuron bevinden, nu het intracellulaire calcium signaleren, verhogen en een groot aantal calciumafhankelijke signaalroutes en tweede boodschappers activeren, waaronder door mitogeen geactiveerde proteïnekinase (MAPK), proteïnekinase C (PKC) , proteïnekinase A (PKA) en Src. Deze cascade van gebeurtenissen zal de prikkelbaarheid van het uitgangsneuron vergroten en de overdracht van pijnberichten naar de hersenen vergemakkelijken.
- Ontremming.Onder normale omstandigheden geven remmende interneuronen (blauw) continu GABA en/of glycine (Gly) af om de prikkelbaarheid van lamina I-uitgangsneuronen te verminderen en pijnoverdracht (remmende toon) te moduleren. Bij een blessure kan deze remming echter verloren gaan, wat resulteert in hyperalgesie. Bovendien kan disinhibitie niet-nociceptieve gemyeliniseerde A? primaire afferenten om de pijntransmissiecircuits in te schakelen, zodat normaal onschadelijke stimuli nu als pijnlijk worden ervaren. Dit gebeurt gedeeltelijk door de ontremming van prikkelende PKC? tot expressie brengen van interneuronen in de binnenste lamina II.
- Microgliale activering.Perifere zenuwbeschadiging bevordert de afgifte van ATP en de chemokine fractalkine die microgliale cellen zal stimuleren. Met name activering van purinerge, CX3CR1- en Toll-achtige receptoren op microglia (paars) resulteert in de afgifte van van de hersenen afgeleide neurotrofe factor (BDNF), die door activering van TrkB-receptoren die tot expressie worden gebracht door lamina I-uitgangsneuronen, verhoogde prikkelbaarheid bevordert en verhoogde pijn als reactie op zowel schadelijke als onschadelijke stimulatie (dat wil zeggen, hyperalgesie en allodynie). Geactiveerde microglia geven ook een groot aantal cytokinen af, zoals tumornecrosefactor? (TNF?), interleukine-1? en 6 (IL-1?, IL-6) en andere factoren die bijdragen aan centrale sensitisatie.
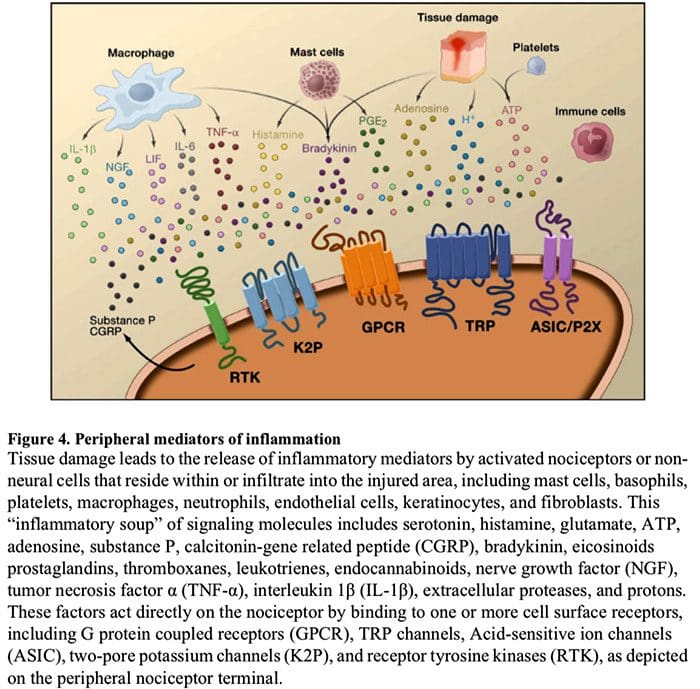
Het chemische milieu van ontsteking
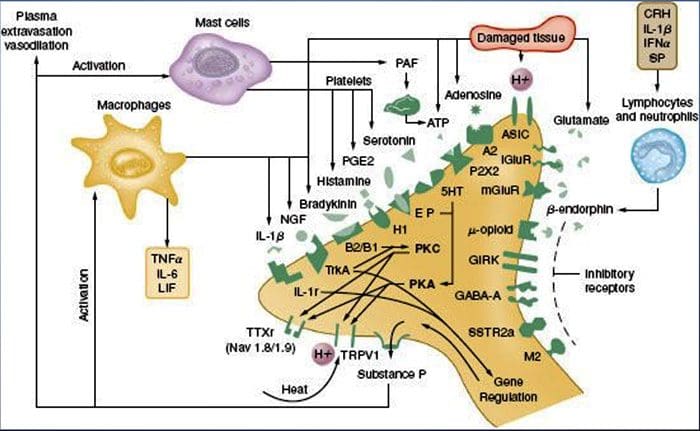
Perifere sensibilisatie is vaker het gevolg van ontstekingsgerelateerde veranderingen in de chemische omgeving van de zenuwvezel (McMahon et al., 2008). Weefselschade gaat dus vaak gepaard met de accumulatie van endogene factoren die vrijkomen uit geactiveerde nociceptoren of niet-neurale cellen die zich in het gewonde gebied bevinden of erin infiltreren (inclusief mestcellen, basofielen, bloedplaatjes, macrofagen, neutrofielen, endotheelcellen, keratinocyten en fibroblasten). Collectief. deze factoren, de ontstekingssoep genoemd, vertegenwoordigen een breed scala aan signaalmoleculen, waaronder neurotransmitters, peptiden (stof P, CGRP, bradykinine), eicosinoïden en verwante lipiden (prostaglandinen, thromboxanen, leukotriënen, endocannabinoïden), neurotrofinen, cytokinen , en chemokinen, evenals extracellulaire proteasen en protonen. Opmerkelijk is dat nociceptoren een of meer receptoren op het celoppervlak tot expressie brengen die in staat zijn om elk van deze pro-inflammatoire of pro-algetische middelen te herkennen en erop te reageren (Figuur 4). Dergelijke interacties versterken de prikkelbaarheid van de zenuwvezel, waardoor de gevoeligheid voor temperatuur of aanraking toeneemt.
De meest voorkomende benadering om inflammatoire pijn te verminderen, is ongetwijfeld het remmen van de synthese of accumulatie van componenten van de ontstekingssoep. Dit wordt het best geïllustreerd door niet-steroïde anti-inflammatoire geneesmiddelen, zoals aspirine of ibuprofen, die ontstekingspijn en hyperalgesie verminderen door cyclo-oxygenasen (Cox-1 en Cox-2) die betrokken zijn bij prostaglandinesynthese te remmen. Een tweede benadering is om de acties van ontstekingsreacties bij de nociceptor te blokkeren. Hier lichten we voorbeelden toe die nieuw inzicht verschaffen in cellulaire mechanismen van perifere sensitisatie, of die de basis vormen voor nieuwe therapeutische strategieën voor de behandeling van ontstekingspijn.
NGF is misschien het best bekend om zijn rol als neurotrofe factor die nodig is voor de overleving en ontwikkeling van sensorische neuronen tijdens de embryogenese, maar in de volwassene wordt NGF ook geproduceerd in de setting van weefselbeschadiging en vormt een belangrijk onderdeel van de ontstekingssoep (Ritner et al., 2009). Van de vele cellulaire doelwitten werkt NGF rechtstreeks op peptidergische C-vezel-nociceptoren, die de hoge affiniteit van NGF-receptortyrosinekinase, TrkA tot expressie brengen, evenals de neurotrofe receptor met lage affiniteit, p75 (Chao, 2003; Snider en McMahon, 1998). NGF produceert een diepe overgevoeligheid voor warmte en mechanische stimuli door twee tijdelijk verschillende mechanismen. In eerste instantie activeert een NGF-TrkA-interactie stroomafwaartse signaalroutes, waaronder fosfolipase C (PLC), door mitogeen geactiveerd proteïnekinase (MAPK) en fosfoinositide 3-kinase (PI3K). Dit resulteert in functionele versterking van doeleiwitten aan de perifere nociceptor-terminal, met name TRPV1, hetgeen leidt tot een snelle verandering in cellulaire en gedragswarmtegevoeligheid (Chuang et al., 2001).
Ongeacht hun pro-nociceptieve mechanismen, is interferentie met neurotrofine- of cytokinesignalering een belangrijke strategie geworden voor het beheersen van ontstekingsziekte of resulterende pijn. De belangrijkste benadering is het blokkeren van NGF of TNF-? werking met een neutraliserend antilichaam. In het geval van TNF-? is dit opmerkelijk effectief gebleken bij de behandeling van talrijke auto-immuunziekten, waaronder reumatoïde artritis, wat heeft geleid tot een dramatische vermindering van zowel weefselvernietiging als bijbehorende hyperalgesie (Atzeni et al., 2005). Omdat de belangrijkste acties van NGF op de volwassen nociceptor plaatsvinden in de setting van een ontsteking, is het voordeel van deze benadering dat hyperalgesie zal afnemen zonder dat dit effect heeft op normale pijnperceptie. Inderdaad, anti-NGF-antilichamen zijn momenteel in klinische onderzoeken voor de behandeling van inflammatoire pijnsyndromen (Hefti et al., 2006).
Glutamaat / NMDA Receptor-gemedieerde sensibilisatie
Acute pijn wordt gesignaleerd door de afgifte van glutamaat uit de centrale klemmen van nociceptoren, waarbij exciterende post-synaptische stromen (EPSC's) worden gegenereerd in tweede orde dorsale hoornneuronen. Dit gebeurt voornamelijk door activering van postsynaptische AMPA- en kaïnaatsubtypen van ionotrope glutamaatreceptoren. Opsomming van sub-drempelwaarde-EPSC's in het postsynaptische neuron zal uiteindelijk resulteren in actiepotentiaalvervuring en transmissie van de pijnmelding naar hogere orde neuronen.
Andere studies geven aan dat veranderingen in het projectie-neuron zelf bijdragen aan het dis-remmende proces. Bijvoorbeeld, perifere zenuwbeschadiging reduceert de K + - Cl-co-transporter KCC2 grondig naar beneden, wat essentieel is voor het handhaven van normale K + - en Cl-gradiënten over het plasmamembraan (Coull et al., 2003). Het downreguleren van KCC2, dat wordt uitgedrukt in lamina I-projectie-neuronen, resulteert in een verschuiving in de Cl-gradiënt, zodat activering van GABA-A-receptoren de lamina I-projectie-neuronen depolariseert in plaats van hyperpolarisatie. Dit zou op zijn beurt de prikkelbaarheid verhogen en de pijnoverdracht vergroten. Inderdaad induceert farmacologische blokkade of door siRNA gemedieerde neerwaartse regulatie van KCC2 bij de rat mechanische allodynie.
Bronnen:
Waarom doet mijn schouder pijn? Een overzicht van de neuroanatomische en biochemische basis van schouderpijn
Benjamin John Floyd Dean, Stephen Edward Gwilym, Andrew Jonathan Carr
Cellulaire en moleculaire pijnmechanismen
Allan I. Basbaum1, Diana M. Bautista2, Gre? Gory Scherrer1 en David Julius3
1Department of Anatomy, University of California, San Francisco 94158
2Department of Molecular and Cell Biology, University of California, Berkeley CA 94720 3Department of Physiology, University of California, San Francisco 94158
Moleculaire mechanismen van nociceptie
David Julius * en Allan I. Basbaum
*Afdeling Cellulaire en Moleculaire Farmacologie, en Afdelingen Anatomie en Fysiologie en WM Keck Foundation Center for Integrative Neuroscience, University of California San Francisco, San Francisco, California 94143, VS (e-mail: julius@socrates.ucsf.edu)
Professionele reikwijdte van de praktijk *
De informatie hierin over "Biochemie van pijn" is niet bedoeld ter vervanging van een een-op-een relatie met een gekwalificeerde zorgverlener of gediplomeerde arts en is geen medisch advies. We moedigen u aan om beslissingen over de gezondheidszorg te nemen op basis van uw onderzoek en samenwerking met een gekwalificeerde zorgverlener.
Blog Informatie & Scope Discussies
Ons informatiebereik: is beperkt tot chiropractie, musculoskeletale, fysieke medicijnen, welzijn, bijdragende etiologische viscerosomatische stoornissen binnen klinische presentaties, geassocieerde somatoviscerale reflex klinische dynamiek, subluxatiecomplexen, gevoelige gezondheidskwesties en/of functionele geneeskunde artikelen, onderwerpen en discussies.
Wij bieden en presenteren klinische samenwerking met specialisten uit verschillende disciplines. Elke specialist wordt beheerst door hun professionele praktijk en hun jurisdictie van licentiestatus. We gebruiken functionele gezondheids- en welzijnsprotocollen om de verwondingen of aandoeningen van het bewegingsapparaat te behandelen en te ondersteunen.
Onze video's, berichten, onderwerpen, onderwerpen en inzichten behandelen klinische zaken, problemen en onderwerpen die verband houden met en direct of indirect onze klinische praktijk ondersteunen.*
Ons kantoor heeft redelijkerwijs geprobeerd om ondersteunende citaten te geven en heeft de relevante onderzoeksstudie of studies geïdentificeerd die onze berichten ondersteunen. Wij verstrekken kopieën van ondersteunende onderzoeksstudies die op verzoek beschikbaar zijn voor regelgevende instanties en het publiek.
We begrijpen dat we zaken behandelen die een aanvullende uitleg vereisen over hoe het kan helpen bij een bepaald zorgplan of behandelprotocol; daarom, om het onderwerp hierboven verder te bespreken, aarzel dan niet om te vragen Dr. Alex Jimenez, DC, of neem contact met ons op 915-850-0900.
Wij zijn er om u en uw gezin te helpen.
zegeningen
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licentie als Doctor of Chiropractic (DC) in Texas & New Mexico*
Texas DC-licentie # TX5807, New Mexico DC-licentie # NM-DC2182
Licentie als geregistreerde verpleegkundige (RN*) in Florida
Florida-licentie RN-licentie # RN9617241 (controle nr. 3558029)
Compacte status: Licentie voor meerdere staten: Geautoriseerd om te oefenen in 40 Staten*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mijn digitale visitekaartje







