Neuro-ontsteking:
Abstract
Meerdere bewijslijnen ondersteunen de pathogene rol van neuro-inflammatie bij psychiatrische aandoeningen. Hoewel systemische auto-immuunziekten goed gedocumenteerde oorzaken zijn van neuropsychiatrische aandoeningen, worden synaptische auto-immuunencefalitiden met psychotische symptomen vaak onvoldoende herkend. Parallel aan het verband tussen psychiatrische symptomen en auto-immuniteit bij auto-immuunziekten, komen neuro-immunologische afwijkingen voor bij klassieke psychiatrische stoornissen (bijvoorbeeld depressieve, bipolaire, schizofrenie en obsessief-compulsieve stoornissen). Onderzoeken naar de pathofysiologie van deze aandoeningen benadrukten traditioneel de ontregeling van de glutamaterge en monoaminerge systemen, maar de mechanismen die deze neurotransmitterafwijkingen veroorzaakten, bleven ongrijpbaar. We bespreken het verband tussen auto-immuniteit en neuropsychiatrische stoornissen, en het menselijke en experimentele bewijs ter ondersteuning van de pathogene rol van neuro-inflammatie bij geselecteerde klassieke psychiatrische stoornissen. Door te begrijpen hoe psychosociale, genetische, immunologische en neurotransmittersystemen op elkaar inwerken, kunnen pathogene aanwijzingen worden onthuld en nieuwe preventieve en symptomatische therapieën worden ingezet.
sleutelwoorden:
- Neuro-ontsteking,
- Psychoneuroimmunologie,
- Astrocyt,
- microglia,
- Cytokinen,
- Oxidatieve stress,
- depressie,
- Obsessief-compulsieve stoornis,
- Bipolaire stoornis, schizofrenie
Inhoud
Introductie
Naarmate biologische afwijkingen bij patiënten met psychiatrische stoornissen steeds vaker worden vastgesteld, vervaagt het onderscheid tussen neurologische en psychiatrische aandoeningen. Naast systemische auto-immuunziekten geassocieerd met psychiatrische manifestaties (bijvoorbeeld lupus) [1], werden meer recentelijk patiënten met acute geïsoleerde psychose geïdentificeerd met synaptische auto-immuunencefalitiden (tabel 1) [2-6]. Deze patiënten worden vaak ten onrechte gediagnosticeerd met refractaire primaire psychische stoornissen, waardoor de start van effectieve immuuntherapie wordt vertraagd (tabel 1). Bovendien ondersteunt groeiend bewijs de pathogene rol van anti-neuronale antilichamen bij neuropsychiatrische aandoeningen [7].
Scheiding van neurologische en psychiatrische stoornissen, ondersteund door Descartes opvatting van de 'geest' als een ontologisch onderscheiden entiteit en door de reproduceerbaarheid van neuropathologische afwijkingen, domineerde de geneeskunde in.de 19e en vroege 20e eeuw [8]. Sindsdien heeft een groeiende verzameling reproduceerbare biologische oorzaken, van neurosyfilis, hoofdtrauma, beroerte, tumor, demyelinisatie en vele andere, symptoomcomplexen veroorzaakt die overlapten met klassieke psychiatrische stoornissen [9-11]. Meer recent zijn neuro-inflammatoire en immunologische afwijkingen gedocumenteerd bij patiënten met klassieke psychiatrische stoornissen.
Perifere immuunmodulatoren kunnen psychiatrische symptomen induceren in diermodellen en mensen [12-19]. Gezonde dieren geïnjecteerd met pro-inflammatoire IL-1? en tumornecrosefactor-alfa (TNF-?) cytokines vertonen "ziektegedrag" geassocieerd met sociale terugtrekking [12]. Bij mensen deactiveren injecties met een lage dosis endotoxine het ventrale striatum, een gebied dat cruciaal is voor de verwerking van beloningen, waardoor anhedonie wordt geproduceerd, een slopend depressief symptoom [14]. Ongeveer 45% van de niet-depressieve hepatitis C- en kankerpatiënten behandeld met IFN-? depressieve symptomen ontwikkelen die gepaard gaan met verhoogde serum-IL-6-spiegels [12,15,17,18].
Medische aandoeningen geassocieerd met chronische inflammatoire en immunologische afwijkingen, waaronder obesitas, diabetes, maligniteiten, reumatoïde artritis en multiple sclerose, zijn risicofactoren voor depressie en bipolaire stoornis [10,12,13,15,17,18]. het positieve�correlatie tussen deze medische aandoeningen en psychiatrische ziekte suggereert de aanwezigheid van een wijdverbreid onderliggend ontstekingsproces dat de hersenen en andere organen aantast [10,19,20]. Een 30 jaar durend bevolkingsonderzoek toonde aan dat het hebben van een auto immuunziekte of een eerdere ziekenhuisopname voor een ernstige infectie verhoogde het risico op het ontwikkelen van schizofrenie met respectievelijk 29% en 60% [16]. Verder verhogen herpes simplex-virus, Toxoplasma gondii, cytomegalovirus en influenza tijdens de zwangerschap het risico op het ontwikkelen van schizofrenie [16].
Perifere cellulaire [21,22] (Tabel 2) en humorale immunologische afwijkingen [13,21-23] komen vaker voor bij psychiatrische patiënten dan bij gezonde controles. In zowel pilot- (n = 34 patiënten met depressieve stoornis (MDD), n = 43 gezonde controles) als replicatieonderzoeken (n = 36 MDD, n = 43 gezonde controles) onderscheidde een serumtest met negen serumbiomarkers MDD-patiënten van gezonde controles met 91.7% sensitiviteit en 81.3% specificiteit; significant verhoogde biomarkers voor neuropsychiatrische symptomen waren de immunologische moleculen alfa-1 antitrypsine, myeloperoxidase en oplosbaar TNF-? receptor II [23].
 We bespreken eerst de associatie tussen auto-immuniteit en neuropsychiatrische aandoeningen, waaronder: 1) systemische lupus erythematosus (SLE) als prototype van systemische auto-immuunziekte; 2) auto-immuun encefalitiden geassocieerd met serum anti-synaptische en glutaminezuur decarboxylase (GAD) auto-antilichamen; en 3) pediatrische neuropsychiatrische auto-immuunziekten geassocieerd met streptokokkeninfecties (PANDAS) en pure obsessieve-compulsieve stoornis (OCS) geassocieerd met anti-basale ganglia/thalamische auto-antilichamen. Vervolgens bespreken we de rol van aangeboren ontsteking/auto-immuniteit bij klassieke psychiatrische stoornissen, waaronder MDD, bipolaire stoornis (BPD), schizofrenie en OCS.
We bespreken eerst de associatie tussen auto-immuniteit en neuropsychiatrische aandoeningen, waaronder: 1) systemische lupus erythematosus (SLE) als prototype van systemische auto-immuunziekte; 2) auto-immuun encefalitiden geassocieerd met serum anti-synaptische en glutaminezuur decarboxylase (GAD) auto-antilichamen; en 3) pediatrische neuropsychiatrische auto-immuunziekten geassocieerd met streptokokkeninfecties (PANDAS) en pure obsessieve-compulsieve stoornis (OCS) geassocieerd met anti-basale ganglia/thalamische auto-antilichamen. Vervolgens bespreken we de rol van aangeboren ontsteking/auto-immuniteit bij klassieke psychiatrische stoornissen, waaronder MDD, bipolaire stoornis (BPD), schizofrenie en OCS.
Neuropsychiatrische aandoeningen die verband houden met auto-immuniteit
Systemische lupus erythematodes
Tussen 25% en 75% van de SLE-patiënten heeft betrokkenheid van het centrale zenuwstelsel (CZS), waarbij psychiatrische symptomen doorgaans optreden binnen de eerste twee jaar na het begin van de ziekte. Psychische symptomen kunnen angst, stemming en psychotische stoornissen zijn [97]. Hersenen magnetische resonantie beeldvorming (MRI) is normaal in ongeveer 42% van de neuropsychiatrische SLE-gevallen [97]. Door microangiopathie en afbraak van de bloed-hersenbarrière (BBB) kunnen auto-antilichamen de hersenen binnendringen [97]. Deze antilichamen omvatten anti-ribosomale P (positief bij 90% van de psychotische SLE-patiënten) [1], anti-endotheelcel, anti-ganglioside, anti-dsDNA, anti-2A/2B-subeenheden van N-methyl-D-aspartaatreceptoren ( NMDAR) en anti-fosfolipide-antilichamen [97]. Pro-inflammatoire cytokines, voornamelijk IL-6 [97], S100B[97], intracellulair adhesiemolecuul 1 [97] en matrix-metalloproteinase-9 [98] zijn ook verhoogd in SLE. Psychiatrische manifestaties van SLE, de ziekte van Sjögren, het syndroom van Susac, vasculitis van het CNS, de ziekte van CNS Whipple en de ziekte van Behcét zijn onlangs beoordeeld [1].
Neuropsychiatrische auto-immuun encefalitiden geassocieerd met antisynaptisch serum en glutaminezuurdecarboxylase
Auto-antilichamen
Auto-immuunencefalitiden worden gekenmerkt door een acuut begin van aanvallen van de temporale kwab, psychiatrische kenmerken en cognitieve stoornissen [2,3,99-108]. De pathofysiologie wordt meestal gemedieerd door auto-antilichamen die zich richten op synaptische of intracellulaire auto-antigenen in combinatie met een paraneoplastische of niet-paraneoplastische oorsprong [3]. Anti-synaptische auto-antilichamen richten zich op NR1-subeenheden van de NMDAR [100,108,109], spanningsafhankelijke kaliumkanaal (VGKC)-complexen (Kv1-subeenheid, leucine-rijk glioom geïnactiveerd (LGI1) en contactine-geassocieerd eiwit 2 (CASPR2)) [101,102,106], GluR1 en GluR2-subeenheden van de amino-3-hydroxy-5-methyl-l-4-isoxazolpropionzuurreceptor (AMPAR) [6,110,111] en B1-subeenheden van de ?-aminoboterzuur B-receptoren (GABABR) [3,99,103]. Anti-intracellulaire auto-antilichamen richten zich op onconeuronale en GAD-65 auto-antigenen [2,3].
De ontsteking geassocieerd met anti-synaptische auto-antilichamen, in het bijzonder NMDAR-auto-antilichamen, is typisch veel milder dan die geassocieerd met GAD-auto-antilichamen of anti-neuronale auto-antilichamen gerelateerd aan systemische auto-immuunziekten of paraneoplastische syndromen [2,107].
Hoewel uiteindelijk neurologische symptomen optreden, kunnen psychiatrische manifestaties, variërend van angst [2,3] tot psychose die schizofrenie nabootst [2-6], aanvankelijk de neurologische kenmerken domineren of eraan voorafgaan. Tot tweederde van de patiënten met anti-NMDAR auto-immuun encefalitis, presenteert zich in eerste instantie bij psychiatrische diensten [5]. Anti-synaptische antilichamen-gemedieerde auto-immuun encefalitiden moeten worden overwogen in het differentieel van acute psychose [2-6]. Psychiatrische presentaties kunnen normale hersen-MRI en cerebrospinale vloeistof (CSF) analyse omvatten, zonder encefalopathie of toevallen [2,3,5,6,107]. We rapporteerden een geval van seropositieve GAD-auto-antilichamen geassocieerd met biopsie-bewezen neuro-inflammatie, ondanks normale hersen-MRI en CSF-analyses, waarbij de patiënt zich presenteerde met geïsoleerde psychose gediagnosticeerd als schizofrenie volgens de diagnostische en statistische handleiding voor psychische stoornissen, 4e editie (DSM-IV) criteria [2]. Verder kunnen seronegatieve auto-immuunencefalitiden zich ook presenteren met prominente neuropsychiatrische stoornissen, waardoor diagnose ongrijpbaarder wordt [107,112,113]. Psychiatrische en neurologische kenmerken geassocieerd met antisynaptische en GAD-auto-antilichamen zijn samengevat in Tabel 1 [1-6,99-108,114].
Serum-antisynaptische en GAD-auto-antilichamen kunnen voorkomen bij patiënten met pure psychiatrische stoornissen [2,4,5,112,115-121]. In een prospectief cohort van 29 proefpersonen die voldeden aan de DSM-IV-criteria voor schizofrenie, werden serum-anti-NMDAR-auto-antilichamen gevonden bij drie proefpersonen en anti-VGKC-complex auto-antilichamen bij één proefpersoon [5]. Met behulp van meer gevoelige technieken om immunoglobuline G (IgG) NR1-auto-antilichamen te detecteren bij 100 patiënten met duidelijke schizofrenie, werden geen auto-antilichamen geïdentificeerd [122]. In deze studie werden echter geen auto-antilichamen beoordeeld die zich richten op de NR2-subeenheid van NMDAR. Andere onderzoeken rapporteerden significant verhoogde kans op verhoogde (?90e percentiel niet-psychiatrische controleniveaus) NR2-antilichaamniveaus (odds ratio (OR) 2.78, 95% betrouwbaarheidsinterval (BI) 1.26 tot 6.14, P = 0.012) bij personen met acute manie ( n = 43), maar niet bij chronische manie of schizofrenie [116].
PANDAS & pure obsessieve-compulsieve stoornis geassocieerd met anti-basale ganglia/thalamische auto-antilichamen
OCS compliceert vaak neurologische aandoeningen waarbij de basale ganglia betrokken zijn, waaronder chorea van Sydenham, de ziekte van Huntington en de ziekte van Parkinson. Anti-basale ganglia-antilichamen zijn betrokken bij de chorea van Sydenham [123]. PANDAS wordt gekenmerkt door acute exacerbaties van OCS-symptomen en/of motorische/fonische tics na een prodromale groep A ?-hemolytische streptokokkeninfectie. Er wordt gedacht dat de pathofysiologie kruisreactiviteit omvat tussen anti-streptokokkenantilichamen en basale ganglia-eiwitten [124]. De klinische overlap tussen de PANDAS en pure OCS suggereert een gemeenschappelijk etiologisch mechanisme [125].
Van een willekeurig cohort van 21 zuivere OCS-patiënten had 91.3% CSF anti-basale ganglia (P <0.05) en anti-thalamische auto-antilichamen (P <0.005) bij 43 kDa [88], parallel aan functionele afwijkingen in de cortico-striatale-thalamo -cortico-circuit van OCS-patiënten [84]. Een andere studie documenteerde dat 42% (n = 21) van OCS pediatrische en adolescente proefpersonen serum anti-basale ganglia auto-antilichamen had bij 40, 45 en 60 kDa vergeleken met 2% tot 10% van de controles (P = 0.001) [7]. Anti-basale ganglia auto-antilichamen werden gedetecteerd in de sera van 64% van de PANDAS-proefpersonen (n = 14), vergeleken met slechts 9% (n = 2) van streptokokken-positieve/OCD-negatieve controles (P <0.001) [126]. Eén studie vond geen verschil tussen de prevalentie van anti-basale ganglia-auto-antilichamen bij OCS (5.4%, n = 4) versus MDD-controles (0%) [127]; een beperking was echter het willekeurige gebruik van de cortex van de rat en de basale ganglia en cortex van runderen die de identificatie van seropositieve gevallen mogelijk hebben beperkt.
De auto-antigenen van de basale ganglia zijn aldolase C (40 kDa), neuronaal specifiek/niet-neuronaal enolase (45 kDa doublet) en pyruvaatkinase M1 (60 kDa) neuronale glycolytische enzymen die betrokken zijn bij neurotransmissie, neuronaal metabolisme
Pagina 3 van 24 en celsignalering [128]. Deze enzymen vertonen een substantiële structurele homologie met streptokokkeneiwitten [129]. De meest recente studie (96 OCD, 33 MDD, 17 personen met schizofrenie) testte patiëntenserum tegen specifiek pyruvaatkinase, aldolase C en enolase; een groter deel van de OCS-patiënten was seropositief in vergelijking met controles (19.8% (n = 19) versus 4% [n = 2], P = 0.012) [130].
Maar in hetzelfde onderzoek had slechts één van de 19 seropositieve OCS-patiënten ook positieve anti-streptolysine O-antilichaamtiters, wat suggereert dat bij pure OCS de anti-streptolysine O-antilichaamseronegativiteit de aanwezigheid van anti-basale ganglia-auto-antilichamen niet uitsluit. .
Bij pure OCS is seropositiviteit voor anti-basale ganglia/thalamische antilichamen geassocieerd met verhoogde niveaus van CSF-glycine (P = 0.03) [88], wat suggereert dat deze antilichamen bijdragen aan hyperglutamatergie waargenomen bij OCS [84,88,131]. De verbetering van door infectie veroorzaakte OCS met immuuntherapieën ondersteunt de pathogeniteit van deze auto-antilichamen [132]. Er loopt een groot NIH-onderzoek naar de werkzaamheid van intraveneus immunoglobuline (IVIG) voor kinderen met acute OCS en anti-streptokokkenantilichamen (ClinicalTrials.gov: NCT01281969). De bevinding van iets hogere CSF-glutamaatniveaus bij OCS-patiënten met negatieve CSF-anti-basale ganglia/thalamische antilichamen in vergelijking met die met positieve CSF-antilichamen suggereert echter dat niet-immunologische mechanismen een rol kunnen spelen bij OCS [84]. Andere mechanismen, waaronder cytokine-gemedieerde ontsteking (Tabel 2), worden ook verondersteld.
Psychische stoornissen die verband houden met aangeboren ontsteking
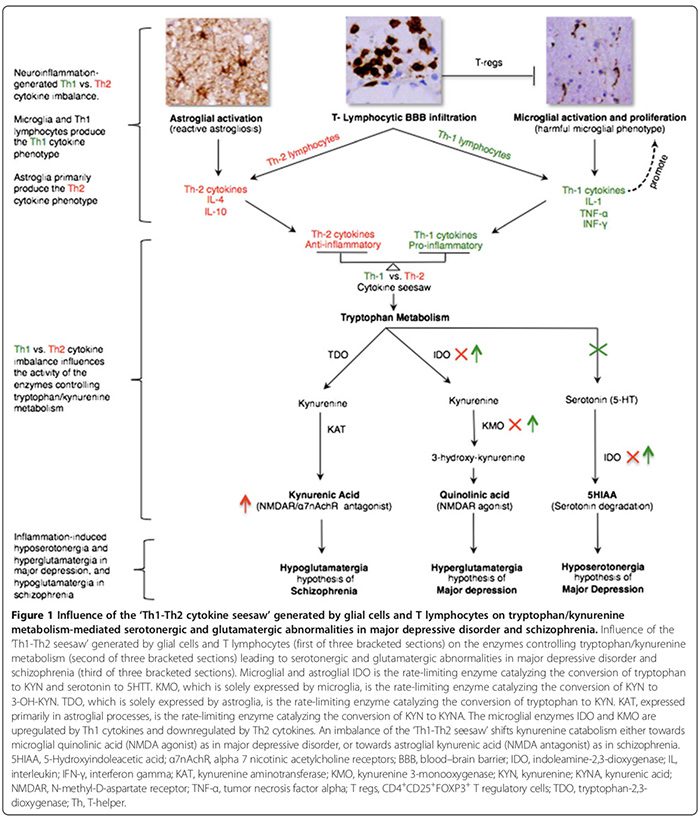
Aandoeningen van aangeboren ontsteking/auto-immuniteit komen voor bij sommige patiënten met klassieke psychiatrische stoornissen. We bespreken aangeboren ontstekingsgerelateerde CZS-afwijkingen, waaronder gliale pathologie, verhoogde cytokineniveaus, cyclo-oxygenase-activering, glutamaatontregeling, verhoogde S100B-niveaus, verhoogde oxidatieve stress en BBB-disfunctie bij MDD, BPD, schizofrenie en OCD. We beschrijven ook hoe aangeboren ontsteking mechanistisch kan worden gekoppeld aan de traditionele monoaminerge en glutamaterge afwijkingen die bij deze aandoeningen worden gerapporteerd (figuren 1 en 2). De therapeutische rol van ontstekingsremmende middelen bij psychiatrische stoornissen wordt ook besproken.
 Astrogliale en oligodendrogliale histopathologie
Astrogliale en oligodendrogliale histopathologie
Astroglia en oligodendroglia zijn essentieel voor neurale stofwisselings- homeostase, gedrag en hogere cognitieve functies [54-56,133-136]. Normale rustende astroglia leveren energie en trofische ondersteuning aan neuronen, reguleren synaptische neurotransmissie (Figuur 2), synaptogenese, cerebrale bloedstroom en handhaven BBB-integriteit [134,136,137]. Volwassen oligodendroglia bieden energie en trofische ondersteuning aan neuronen, behouden de BBB-integriteit en reguleren axonaal herstel�en myelinisatie van banen van witte stof die inter- en intra-hemisferische connectiviteit bieden [54-56]. Zowel astroglia als oligodendroglia produceren ontstekingsremmende cytokinen die schadelijke ontstekingen kunnen neerwaarts reguleren [52,55].
Bij MDD is astrogliaal verlies een consistente postmortale bevinding in functioneel relevante gebieden, waaronder de cortex anterior cingulate, prefrontale cortex, amygdala en witte stof [35-38,42-46,55,138-147], op enkele uitzonderingen na [42,43] ,37,38]. Post-mortemstudies onthulden verminderde gliale fibrillair zuur eiwit (GFAP)-positieve astrogliale dichtheid, voornamelijk in de prefrontale cortex [36] en amygdala [39]. Een grote proteomische analyse van frontale cortex van depressieve patiënten toonde significante reducties in drie GFAP-isovormen [75]. Hoewel in één onderzoek dat geen significant gliaverlies rapporteerde, subgroepanalyse een significante afname (45%) in GFAP-positieve astrogliale dichtheid aan het licht bracht bij proefpersonen jonger dan 35 jaar [148]. Een morfometrische studie toonde op dezelfde manier geen veranderingen in gliale dichtheid in MDD-hersenen op latere leeftijd [35]. We veronderstellen dat de schijnbare afwezigheid van astrogliaal verlies bij oudere MDD-patiënten mogelijk een weerspiegeling is van secundaire astrogliose [42,50] die geassocieerd is met hogere leeftijd [XNUMX] in plaats van een echt negatief.
Dierstudies komen overeen met studies bij mensen die astrogliaal verlies bij MDD aantonen. Wistar-Kyoto-ratten waarvan bekend is dat ze depressief gedrag vertonen, onthulden een verminderde astrogliale dichtheid in dezelfde gebieden als waargenomen bij mensen [40]. Toediening van het astroglia-toxische middel, L-alfa-aminoadipinezuur, induceert depressieve symptomen bij ratten, wat suggereert dat astrogliaal verlies pathogeen is bij MDD [41].
Post-mortemstudies van MDD-patiënten documenteerden verminderde oligodendrogliale dichtheid in de prefrontale cortex en amygdala [54-57,66], wat kan correleren met MRI-focale witte stofveranderingen in de hersenen die af en toe bij sommige MDD-patiënten worden waargenomen [57]. Microvasculaire afwijkingen kunnen echter ook bijdragen aan deze veranderingen [57].
Bij BPS tonen sommige onderzoeken significant gliaverlies [138,143,149,150] aan, terwijl andere dat niet doen [37,44-46]. Deze inconsistente bevindingen kunnen het gevolg zijn van een gebrek aan controle voor: 1) behandeling met stemmingsstabilisatoren, omdat post-hocanalyse die door sommige onderzoeken is gerapporteerd, alleen een significante vermindering van gliaverlies liet zien na controle voor behandeling met lithium en valproïnezuur [46]; 2) familiale vormen van BPS, aangezien gliaverlies vooral prominent aanwezig is bij BPS-patiënten met een sterke familiegeschiedenis [143]; en/of, 3) de overheersende toestand van depressie versus manie, aangezien gliaverlies vaak voorkomt bij MDD [35-38,42-46,55,138-147]. Of astroglia of oligodendroglia verantwoordelijk zijn voor het grootste deel van het gliale verlies is onduidelijk; terwijl proteomische analyse een significante afname van één astrogliale GFAP-isovorm [39] aan het licht bracht, vonden verschillende andere post-mortemstudies ofwel onveranderd [36,37] of verminderde GFAP-positieve astrogliale expressie in de orbitrofrontale cortex [47], of verminderde oligodendrogliale dichtheid [ 54-56,58,59].
Bij schizofrenie is astrogliaal verlies een inconsistente bevinding [48,150]. Terwijl sommige onderzoeken geen significant astrogliaal verlies [42,50,51] lieten zien, vonden verschillende andere verminderde astrogliale dichtheid [37,38,43,44,48,49,151] en significante verminderingen in twee GFAP-isovormen [39]. Inconsistente bevindingen kunnen het gevolg zijn van: 1) MDD-comorbiditeit, die vaak wordt geassocieerd met gliaal verlies; 2) leeftijdsvariatie, aangezien oudere patiënten verhoogde GFAP-positieve astroglia hebben [35,42,50]; 3) regionale [150] en corticale laagvariabiliteit [48]; 4) behandeling met antipsychotica, aangezien experimentele studies zowel een verminderde [152] als een verhoogde [153] astrogliale dichtheid laten zien in verband met chronische antipsychotische behandeling [70]; en 5) ziektetoestand (bijvoorbeeld suïcidaal versus niet-suïcidaal gedrag) [154]. Post-mortemstudies documenteerden oligodendrogliaal verlies [54,56,60-65,148,155,156], met name in de prefrontale cortex, cortex anterior cingulate en hippocampus [148]. Ultrastructureel onderzoek van het prefrontale gebied toonde abnormaal gemyeliniseerde vezels in zowel grijze als witte stof; zowel leeftijd als ziekteduur waren positief gecorreleerd met de afwijkingen in de witte stof [157].
In tegenstelling tot neurodegeneratieve aandoeningen die vaak worden geassocieerd met astrogliale proliferatie [136], worden psychiatrische stoornissen in plaats daarvan geassocieerd met verminderde of onveranderde astrogliale dichtheid [138]. Het ontbreken van verhoogde gliale dichtheid bij psychiatrische stoornissen met vroege aanvang [44,138] kan een weerspiegeling zijn van de langzamere snelheid van degeneratieve progressie bij psychiatrische aandoeningen [138].
We postuleren dat degeneratieve veranderingen geassocieerd met psychiatrische stoornissen subtieler zijn en niet ernstig genoeg om astrogliale intracellulaire transcriptiefactoren op te wekken die astrogliose positief reguleren, inclusief signaaltransducer activator van transcriptie 3 en nucleaire factor kappa B (NF-?B) [136].
Terwijl de meeste postmortale onderzoeken zich richtten op de verandering van gliale dichtheid bij MDD, BPD en schizofrenie, beschreven anderen verandering van gliacelmorfologie, met gemengde bevindingen. Bij MDD en BPD is de gliale grootte vergroot of onveranderd [55]. Eén studie vond verminderde gliale grootte bij BPD en schizofrenie, maar niet bij MDD [43]. Een postmortaal onderzoek van depressieve patiënten die zelfmoord pleegden, vond een grotere astrogliale grootte in de anterieure cingulate witte stof, maar niet in de cortex [158]. Een studie bij schizofrene proefpersonen vond een duidelijk verminderde astrogliale grootte in laag V van de dorsolaterale prefrontale cortex, ondanks dat de astrogliale dichtheid het dubbele is van die van controles in dezelfde laag [48]. De gemengde resultaten weerspiegelen mogelijk gedeeltelijk eerdere onderzoeken naar gliale veranderingen bij psychiatrische ziekten die geen astroglia versus oligodendroglia specificeerden [148].
Gliaverlies bij psychiatrische aandoeningen kan via verschillende mechanismen bijdragen aan neuro-inflammatie, waaronder abnormale cytokineniveaus (zie rubriek Cytokine), ontregeld glutamaatmetabolisme (zie rubriek Glutamaat), verhoogd S100B-eiwit (zie rubriek S100B),�en veranderde BBB-functie (zie sectie Bloed-hersenbarrière), resulterend in verminderde cognitie en gedrag [44,45,54,133,159].
Microgliale histopathologie
Microglia zijn de residente immuuncellen van het CZS. Ze bieden doorlopend immuunsurveillance en reguleren ontwikkelingssynaptische snoei [160,161]. CZS-beschadiging transformeert vertakte rustende microglia in geactiveerde langwerpige staafvormige en macrofaagachtige fagocytische amoeboïde cellen die prolifereren en migreren naar de plaats van verwonding langs chemotactische gradiënten (dat wil zeggen, microgliale activering en proliferatie (MAP)) [161]. Menselijke microgliale cellen brengen NMDAR's tot expressie die MAP kunnen mediëren, wat leidt tot neuronale schade [162].
Bij MDD, BPD en schizofrenie zijn de resultaten van postmortaal onderzoek naar de aanwezigheid van MAP gemengd. Post-mortemstudies onthulden verhoogde MAP bij slechts één op de vijf MDD-proefpersonen [67]. Bij sommige patiënten met een BPS-stoornis werden verhoogde humane leukocytenantigeen-DR-positieve microglia met verdikte processen gedocumenteerd in de frontale cortex [69]. Bij schizofrenie, terwijl sommige studies verhoogde MAP rapporteerden ten opzichte van controles, toonden andere geen verschil tussen groepen [22,67,70]. In een postmortaal onderzoek naar MAP bij MDD en BPD; chinolinezuur-positieve microgliale celdichtheid was verhoogd in de subgenuale cortex anterior cingulate en anterior midcingulate cortex van MDD- en BPD-patiënten die zelfmoord pleegden in vergelijking met controles [53]. Post-hoc analyse onthulde dat deze verhoogde MAP uitsluitend toe te schrijven was aan MDD en niet aan BPD, aangezien de positieve microgliale immunokleuring bij MDD-patiënten significant groter was dan die in de BPD-subgroep in zowel de subgenuale anterieure cingulate en midcingulate cortex, en aangezien de microglia-dichtheid was vergelijkbaar in zowel BPD- als controlegroepen [53]. Een onderzoek waarin alle drie de aandoeningen werden vergeleken (negen MDD, vijf BPD, veertien schizofrenie, tien gezonde controles) toonde geen significant verschil in microgliale dichtheid tussen de vier groepen [68].
Deze gemengde resultaten kunnen worden toegeschreven aan variabele microgliale immunologische markers die in verschillende onderzoeken zijn gebruikt [70] en/of het niet controleren op ernst van de ziekte [22,53,68]. Met name drie postmortale onderzoeken van MDD en schizofrene personen documenteerden een sterke positieve correlatie tussen MAP en suïcidaliteit in de cortex anterior cingulate en mediodorsale thalamus, onafhankelijk van psychiatrische diagnose [22,53,68]. MAP kan dus een toestand zijn in plaats van een kenmerkmarkering voor MDD en schizofrenie.
Bij OCS suggereren diermodellen dat disfunctie en vermindering van bepaalde microgliale fenotypes, zoals die die het Hoxb8-gen tot expressie brengen, dat codeert voor de homeobox-transcriptiefactor, OCS-achtig gedrag kan veroorzaken [71,72].
Hoxb8-knock-outmuizen vertonen overmatig verzorgingsgedrag en angst in verband met verminderde microgliale dichtheid [71,72]. Dit overmatige verzorgingsgedrag lijkt op de gedragskenmerken van menselijke OCS. Hoxb8-injectie bij volwassen Hoxb8-knock-outmuizen keert microgliaal verlies om en herstelt normaal gedrag [71,72]. De rol van deze specifieke microgliale fenotypes bij menselijke OCS is onduidelijk.
Experimentele gegevens suggereren dat MAP onderscheidende schadelijke en neuroprotectieve fenotypes omvat (Figuur 2). Schadelijke microglia brengen geen belangrijk histocompatibiliteitscomplex II (MHC-II) tot expressie en kunnen daarom niet werken als antigeenpresenterende cellen (APC) [163,164]; ze bevorderen schadelijke effecten [17,69,165] door pro-inflammatoire cytokineproductie, stikstofoxidesynthase-signalering [17,166], bevorderen gliale en BBB-pericyte/endotheliale cyclo-oxygenase-2 (COX-2) expressie [167], induceren astrogliale S100B-secretie (zie S100B sectie) en microgliale glutamaatafgifte [17,136,168,169]. Schadelijke microglia scheiden ook prostaglandine E-2 (PGE-2) uit dat de productie van pro-inflammatoire cytokines bevordert, wat op zijn beurt de PGE-2-niveaus verhoogt in een feed-forward-cyclus [29]. Verder stimuleert PGE-2 de COX-2-expressie, die de omzetting van arachidonzuur in PGE-2 bemiddelt, waardoor een nieuwe feed-forward-cyclus wordt opgezet [29].
Neuroprotectieve microglia daarentegen kunnen: 1) MHC-II tot expressie brengen in vivo en in vitro [163,166] en werken als verwante APC (Figuur 2) [163,164,166]; 2) genezing te vergemakkelijken en neuronale schade te beperken door de afscheiding van ontstekingsremmende cytokines [17], van de hersenen afgeleide neurotrofe factor [17] en insuline-achtige groeifactor-1 [166] te bevorderen; en 3) brengen excitatoire aminozuurtransporter-2 (EAAT2) tot expressie die overtollig extracellulair glutamaat [163,166] elimineert en neuroprotectieve T-lymfocytische auto-immuniteit bevordert (Figuur 2) [163,164]. Er zijn echter meer studies nodig om de bijdragende rol van neuroprotectieve microglia aan neuropsychiatrische aandoeningen bij mensen te bevestigen.
In vitro dierstudies suggereren dat de verhouding van schadelijke versus neuroprotectieve microglia kan worden beïnvloed door het netto-effect van inflammatoire tegenregulerende mechanismen [15,74,164,166]. Deze mechanismen omvatten het aantal neuroprotectieve CD4+CD25+FOXP3+ T-regulerende cellen ((T regs) Figuur 1) [15,74,164,166] en hersencytokineniveaus; lage IFN-? niveaus kunnen neuroprotectieve microglia bevorderen (Figuur 2) [166], terwijl hoge niveaus het schadelijke fenotype [166] kunnen bevorderen.
De rol van cytokines
Pro-inflammatoire cytokinen omvatten IL-1?, IL-2, IL-6, TNF-? en IFN-?. Ze worden voornamelijk uitgescheiden door microglia, Th1-lymfocyten en M1-fenotype monocyten/macrofagen (Figuur 1) [15,170]. Ze bevorderen schadelijke ontstekingen. Ontstekingsremmende cytokinen omvatten IL-4, IL-5 en IL-10. Ze worden voornamelijk uitgescheiden door astroglia,�Th2-lymfocyten, T-regs en M2-fenotype monocyten/macrofagen [15,52,74]. Ze kunnen schadelijke ontstekingen [15,74] beperken door het pro-inflammatoire M1-fenotype om te zetten in het gunstige anti-inflammatoire M2-fenotype [15], en mogelijk door het neuroprotectieve microgliale fenotype te bevorderen [15,17,74,163,166]. De rol van pro-inflammatoire/anti-inflammatoire cytokines bij psychiatrische stoornissen wordt ondersteund door verschillende bewijslijnen (Figuur 1, Tabel 2) [15,17,29,52,74].
Bij MDD bevestigde de meest recente meta-analyse (29 studies, 822 MDD, 726 gezonde controles) van pro-inflammatoire cytokinen in serum dat oplosbare IL-2-receptor, IL-6 en TNF-? niveaus zijn verhoogd in MDD (eigenschapsmarkers) [91], terwijl IL-1?, IL-2, IL-4, IL-8 en IL-10 niet statistisch verschillen van controles [91]. In een primaire cytokinestudie waarin MDD-subgroepen (47 suïcidale MDD, 17 niet-suïcidale MDD, 16 gezondheidscontroles) werden vergeleken), zowel sera IL-6 als TNF-? waren significant hoger, terwijl de IL-2-niveaus significant lager waren bij MDD-patiënten die zelfmoord pleegden in vergelijking met beide andere groepen [96]. Deze bevinding suggereert dat IL-6 en TNF-? zijn ook toestandsmarkers van MDD [96]. De afname van serum-IL-2-spiegels geassocieerd met acuut suïcidaal gedrag kan een verhoogde binding aan zijn opgereguleerde receptor in de hersenen weerspiegelen; parallel aan de bovengenoemde meta-analyse die een verhoogde oplosbare IL-2-receptor in MDD laat zien [91]. Studies die de klinische betekenis van cytokines bij MDD onderzochten, toonden aan dat serumcytokinespiegels verhoogd zijn tijdens acute depressieve episodes [171,172] en genormaliseerd zijn na succesvolle, maar niet mislukte, behandeling met antidepressiva [17] en elektroconvulsietherapie [29]; deze bevindingen suggereren een mogelijke pathogene rol voor cytokines.
Bij BPD werden veranderingen in serumcytokines samengevat in een recent overzicht; TNF-?, IL-6 en IL-8 zijn verhoogd tijdens manische en depressieve fasen, terwijl IL-2, IL-4 en IL-6 verhoogd zijn tijdens manie [92]. Andere studies toonden aan dat sera IL-1? en IL-1-receptorniveaus zijn niet statistisch verschillend van gezonde controles [92], hoewel weefselstudies verhoogde niveaus van IL-1? en IL-1-receptor in de frontale cortex van de BPD [69].
Bij schizofrenie zijn de resultaten van onderzoeken naar cytokine-afwijkingen tegenstrijdig (tabel 2). Terwijl sommige studies zowel verminderde serum pro-inflammatoire (IL-2, IFN-?) Als verhoogde serum en CSF anti-inflammatoire cytokines (IL-10) [52] vonden, vonden anderen verhoogde serum pro- en anti-inflammatoire cytokines, met een pro-inflammatoire type dominantie [22,173,174 ]. Eén cytokine-meta-analyse (62 onderzoeken, 2,298 schizofrenie, 858 gezonde controles) toonde verhoogde niveaus van IL-1R-antagonist, sIL-2R en IL-6 [174]. Deze studie hield echter geen rekening met het gebruik van antipsychotica, waarvan wordt gedacht dat ze de pro-inflammatoire cytokineproductie verbeteren [52]. Een recentere cytokine-meta-analyse (40 studies, 2,572 schizofrenen,4,401 controles) die verantwoordelijk waren voor antipsychotica, vonden dat TNF-?, IFN-?, IL-12 en sIL-2R consistent verhoogd zijn bij chronische schizofrenie, onafhankelijk van ziekteactiviteit (kenmerkmarkers), terwijl IL-1?, IL-6 en transformerende groeifactor bèta correleert positief met ziekteactiviteit (state markers) [173]. Celkweken van mononucleaire cellen uit perifeer bloed (PBMC) verkregen van schizofrene patiënten produceerden hogere niveaus van IL-8 en IL-1? zowel spontaan als na stimulatie door LPS, wat een rol suggereert voor geactiveerde monocyten/macrofagen bij schizofreniepathologie [175].
Bij OCS zijn de resultaten van een willekeurig onderzoek van sera en CSF-cytokines en LPS-gestimuleerde PBMC-onderzoeken inconsistent [93-95,176-179]. Er is een correlatie tussen OCS en een functioneel polymorfisme in het promotorgebied van de TNF-? gen [34], hoewel studies met een laag vermogen deze associatie niet bevestigden [180]. Daarom zijn de gemengde resultaten van onderzoeken die ofwel verhoogde of verlaagde TNF-? cytokineniveaus [93,176-178] kunnen hun variabele opname van de subset van OCS-patiënten met dit specifieke polymorfisme in hun cohorten weerspiegelen.
Cytokineresponspolarisatie bij ernstige depressie en schizofrenie
Cytokineresponsfenotypen worden geclassificeerd als pro-inflammatoire Th1 (IL-2, IFN-?) of anti-inflammatoire Th2 (IL-4, IL-5, IL-10) volgens de immuunfuncties die ze reguleren. Terwijl Th1-cytokinen celgemedieerde immuniteit reguleren die gericht is tegen intracellulaire antigenen, reguleren Th2-cytokinen de humorale immuniteit gericht tegen extracellulaire antigenen [29,52]. Th1-cytokinen worden geproduceerd door Th1-lymfocyten en M1-monocyten, terwijl Th2-cytokinen worden geproduceerd door Th2-lymfocyten en M2-monocyten [29,52]. In de hersenen scheiden microglia voornamelijk Th1-cytokinen uit, terwijl astroglia voornamelijk Th2-cytokinen afscheiden [29,52]. De wederkerige verhouding van Th1:Th2-cytokinen, voortaan de "Th1-Th2-wip", wordt beïnvloed door de verhouding van geactiveerde microglia (overtollig Th1) tot astroglia (overtollig Th2) en de wisselwerking tussen geactiveerde T-cellen en overmatige glutamaatniveaus van het CZS waarvan we veronderstelden dat ze om de Th1-respons te begunstigen (Figuur 2) [29,163,166].
De onbalans van de Th1-Th2 wipwap kan het tryptofaanmetabolisme beïnvloeden door de enzymen ervan te veranderen [21,52], waardoor het katabolisme van tryptofaan verschuift naar kynurenine (KYN) en KYN-katabolisme naar een van zijn twee stroomafwaartse metabolieten; microglia-chinolinezuur dat door Th1-respons wordt gemedieerd of astrogliaal kynureenzuur (KYNA) (Figuur 1) dat door Th2-respons wordt gemedieerd [21,29,170].
Tryptofaanmetabolisme-enzymen die worden beïnvloed door de Th1-Th2-wip, omvatten (Figuur 1): indoleamine 2,3-dioxygenase (IDO) tot expressie gebracht door microglia en astroglia, de snelheidsbeperkende enzymen die de omzetting van tryptofaan in KYN en serotonine in 5- hydroxyindolazijnzuur�[21,29]. Kynurenine 3-monooxygenase (KMO), uitsluitend tot expressie gebracht door microglia, is het snelheidsbeperkende enzym dat KYN omzet in 3-hydroxykynurenine (3-OH-KYN), dat verder wordt gemetaboliseerd tot chinolinezuur [21,29]. Tryptofaan-2,3-dioxygenase (TDO), uitsluitend tot expressie gebracht door astroglia, is het snelheidsbeperkende enzym dat omzet�tryptofaan naar KYN [21,29]. Kynurenine-aminotransferase (KAT), voornamelijk tot expressie gebracht in astrogliale processen, is het snelheidsbeperkende enzym dat de omzetting van KYN naar KYNA medieert [21,29].
Th1-cytokinen activeren microgliale IDO en KMO, waardoor microgliale KYN-katabolisme verschuift naar quinoline�zuur (NMDAR-agonist) synthese, terwijl Th2-cytokinen microgliale IDO en KMO inactiveren, waardoor het astrogliale KYN-katabolisme verschuift naar TDO- en KAT-gemedieerde KYNA (NMDAR-antagonist) synthese (Figuur 1) [21,29].
Th1 en Th2 overheersende immunofenotypes zijn voorgesteld voor respectievelijk MDD en schizofrenie, gebaseerd op perifere, in plaats van CNS, cytokines patronen [52,173]. Wij zijn van mening dat patronen van perifere cytokines onbetrouwbare surrogaatmarkers zijn van die in het CZS. Perifere cytokineniveaus kunnen inderdaad worden beïnvloed door veel extra-CZS-variabelen, waarvoor in verschillende van de perifere cytokines-onderzoeken niet consequent wordt gecontroleerd, waaronder: 1) leeftijd, body mass index, psychotrope medicatie, roken, stress en circadiane fluctuaties; 2) de invloed van�ziekteactiviteit/toestand op de productie van geselecteerde cytokinensynthese [95,173]; en 3) de effecten van psychotrope middelen op de productie van cytokines [52]. De korte halfwaardetijden en de snelle omzetting van serumcytokinen [181] (bijvoorbeeld 18 minuten voor TNF-a [182] versus 60 minuten voor IL-10 [183]), kunnen de betrouwbaarheid van de interpretatie van hun niveaus gemeten uit willekeurige sera-bemonstering.
Bij MDD is er een consensus dat een pro-inflammatoire Th1 immunofenotype respons overheerst (Tabel 2) [17,29]. Hoge niveaus van chinolinezuur in post-mortem MDD-hersenen [53] wijzen op de aanwezigheid van een opgereguleerde Th1-respons (Figuur 1) [21,29]. Verhoogd chinolinezuur in het CZS kan door calciuminstroom gemedieerde apoptose van menselijke astroglia [184] bevorderen, wat hypothetisch de vorm kan afstompen.van astroglia afgeleide Th2-respons [29], waarbij de balans tussen Th1 en Th2 wordt gekanteld ten gunste van de microgliale Th1-respons. CNS hyposerotonergie [29] voegt verdere ondersteuning toe aan een overmatige Th1-respons, waarvan is aangetoond dat het de serotoninesynthese van het CZS [185] vermindert en de afbraak ervan verhoogt (Figuur 1) [21,29].
CZS-hyperglutamatergie kan ook bijdragen aan een overmatige Th1-respons in de hersenen (Figuur 2). Een in vitro onderzoek suggereert dat de perifere rustende T-lymfocyten constitutief de metabotrope glutamaatreceptor 5 (mGluR5) [164] tot expressie brengen, waarvan de binding aan glutamaat de lymfocytische IL-6-afgifte remt, waardoor de autoreactieve proliferatie van T-effectorcellen wordt verlaagd [164]. Geactiveerde T-lymfocyten, maar geen rustende T-lymfocyten, kunnen de BBB passeren [37].
Experimentele gegevens suggereren dat de interactie tussen T-celreceptoren van geactiveerde T-lymfocyten en hun verwante antigeenpresenterende cellen mGluR5 kan downreguleren en mGluR1-expressies [164] kan induceren. In diermodellen bevordert binding van overtollig glutamaat aan lymfocytische mGluR1-receptoren de productie van Th1-cytokinen, waaronder IFN-? [164].
We veronderstellen dat bij sommige MDD-patiënten, parallel aan experimentele gegevens [164], de binding van overtollig CZS-glutamaat aan geïnduceerde lymfocytische mGluR1-receptoren kan bijdragen aan een overmatige Th1-respons, waaronder IFN-? (Figuur 2). We speculeren dat IFN-? in een kleine hoeveelheid, vergelijkbaar met de in vitro effecten op microglia [166], kan microgliale expressie van MHC-II en EAAT2 [163,166] induceren, waardoor microglia kan dienen als verwante antigeenpresenterende cellen en glutamaatheropnamefunctie [163,164,166], waardoor schadelijke microglia worden getransformeerd in neuroprotectief fenotype [163,166] dat deelneemt aan het elimineren van overtollig extracellulair glutamaat [163,164,166]. Daarom veronderstellen we ook dat overmatige Th1-respons in subgroepen van MDD-patiënten een tweesnijdend zwaard is, schadelijke ontstekingen bevordert en dient als een gunstig tegenregulerend mechanisme dat overmatige glutamaatgerelateerde neuro-excitotoxiciteit kan beperken (Figuur 2).
Bij schizofrenie, terwijl sommige perifere cytokine-onderzoeken de overheersing van een ontstekingsremmend Th2-immunofenotype/respons [52] suggereren, weerleggen anderen dit [173,174]. We zijn het echter eens met de auteurs die veronderstelden dat de Th2-respons het dominante fenotype is bij schizofrenie [52]. Verhoogde hersen-, CSF- en serumspiegels van KYNA [21,52] suggereren neerwaartse regulatie van microgliale IDO en KMO, wat een functie is van de Th2-respons die het astrogliale KYN-katabolisme verschuift naar KYNA-synthese (Figuur 1) [21,52]. Verminderde KMO-activiteit en KMO-mRNA-expressie in post-mortem schizofrene hersenen [73] is consistent met overmatige Th2-respons (Figuur 1). Verhoogde prevalentie van Th2-gemedieerde humorale immuniteitsafwijkingen in subgroepen van schizofreniepatiënten, zoals blijkt uit een verhoogd aantal B-cellen [21,76], verhoogd.productie van auto-antilichamen, waaronder antivirale antilichamen [76] en verhoogde immunoglobuline E [52] - voegt verdere ondersteuning toe aan de Th2-responsdominantie-hypothese.
Neuro-inflammatie en Glutamaatontregeling van het centrale zenuwstelsel
Glutamaat bemiddelt cognitie en gedrag [186]. Synaptische glutamaatniveaus worden gereguleerd door natriumafhankelijke gliale en neuronale EAAT's met hoge affiniteit, namelijk het XAG-systeem dat verantwoordelijk is voor glutamaatheropname/aspartaatafgifte [137,164] en het natriumonafhankelijke astrogliale glutamaat/cystine-antiportersysteem (Xc-) verantwoordelijk voor glutamaatafgifte/cystineheropname [164]. Astrogliale EAAT1 en EAAT2 zorgen voor meer dan 90% van de heropname van glutamaat [79].
Neuro-ontsteking kan het glutamaatmetabolisme en de functie van zijn transporters [15,29,187,188] veranderen, waardoor cognitieve, gedrags- en psychiatrische stoornissen ontstaan [15,21,29,79,186,188,189]. Afwijkingen van de functie/expressie van EAAT en het glutamaatmetabolisme bij MDD, BPD, schizofrenie en OCS zijn samengevat in Tabel 2.
Bij MDD is er bewijs voor corticale hyperglutamatergie (tabel 2). Corticale glutamaatspiegels correleerden positief met de ernst van depressieve symptomen, en een kuur van vijf weken met antidepressiva verlaagde de serumglutamaatconcentraties [85,86]. Een enkele dosis ketamine, een krachtige NMDAR-antagonist, kan een week lang ongevoelige MDD omkeren [17,21,29,85]. Overmatige CZS-glutamaatniveaus kunnen neurotoxiciteit-gemedieerde ontsteking [163,164,188] induceren, waaronder een pro-inflammatoire Th1-respons (Figuur 2) [164].
Beperkt in vitro bewijs suggereert dat ontstekings-/pro-inflammatoire cytokines de glutamaatniveaus van het CZS [188] in een feed-forward-cyclus kunnen verhogen via verschillende mogelijke mechanismen: 1) pro-inflammatoire cytokines kunnen [15,17,168] remmen en [45,137] astrogliale EAAT-gemedieerde glutamaat omkeren heropname functie; 2) pro-inflammatoire cytokinen kunnen de microgliale quinolinezuursynthese versterken [53], waarvan experimenteel is aangetoond dat het de synaptosomale glutamaatafgifte bevordert [15,17,29,190]; 3) verhoogde COX-2/PGE-2 en TNF-? niveaus kunnen calciuminstroom [137] induceren, wat, op basis van in vitro gegevens, de afgifte van astrogliale glutamaat en D-serine [191] kan verhogen; en 4) geactiveerde microglia kunnen overtollige Xc-antiporter-systemen tot expressie brengen die glutamaatafgifte mediëren [164,192].
Bij schizofrenie worden prefrontale corticale hypoglutamatergie [87,90,193,194] (Tabel 2) en verminderde NMDAR-functionaliteit gevonden [5]. Recente H1 magnetische resonantie spectroscopie (MRS) meta-analyse (28 studies, 647 schizofrenie, 608 controle) bevestigde verminderde glutamaat en verhoogde glutamine niveaus in de mediale frontale cortex [90]. De bijdragende rol van ontstekingen aan hypoglutamatergie is niet bewezen. Verhoogde KYNA-synthese in de hersenen van schizofrenie [21,52], typisch een functie van de Th2-respons (Figuur 1), kan de NR1-subeenheid van NMDAR en alfa 7-nicotinicum remmen�acetylcholinereceptor (?7nAchR) [195], wat leidt tot verminderde NMDAR-functie en verminderde door ?7nAchR gemedieerde glutamaatafgifte [195].
Bij BPD en OCS suggereren gegevens corticale hyperglutamatergie van het CZS bij beide aandoeningen (Tabel 2) [78,84,88,131]. De bijdrage van ontsteking (BPD en OCS) en auto-antilichamen (OCD) [7,77,84,88,130] aan verhoogde CZS-glutamaatniveaus vereist nader onderzoek.
De rol van S100B
S100B is een 10 kDa calciumbindend eiwit geproduceerd door astroglia, oligodendroglia en choroïde plexus ependymale cellen [196]. Het medieert de effecten ervan op de omliggende neuronen en glia via de receptor voor het geavanceerde glycatie-eindproduct [196]. Nanomolaire extracellulaire S100B-niveaus zorgen voor gunstige neurotrofe effecten, beperken stressgerelateerde neuronale schade, remmen microgliale TNF-? vrijkomen en de heropname van astrogliale glutamaat verhogen [196]. Micromolaire S100B-concentraties, voornamelijk geproduceerd door geactiveerde astroglia en lymfocyten [196,197], hebben schadelijke effecten die worden getransduceerd door de receptor voor het eindproduct van geavanceerde glycatie, waaronder neuronale apoptose, productie van COX-2/PGE-2, IL-1? en induceerbare stikstofmonoxidesoorten, en opregulatie van monocytische/microgliale TNF-? afscheiding [21,196,198].
Serum en in het bijzonder CSF en hersenweefsel S100B-niveaus zijn indicatoren van gliale (voornamelijk astrogliale) activering [199]. Bij MDD en psychose correleren serum S100B-spiegels positief met de ernst van suïcidaliteit, onafhankelijk van psychiatrische diagnose [200]. Post-mortemanalyse van S100B toonde verminderde niveaus in de dorsolaterale prefrontale cortex van MDD en BPD, en verhoogde niveaus in de pariëtale cortex van BPD [196].
Meta-analyse (193 stemmingsstoornis, 132 gezonde controles) bevestigde verhoogde serum- en CSF S100B-spiegels bij stemmingsstoornissen, vooral tijdens acute depressieve episodes en manie [201].
Bij schizofrenie zijn de hersen-, CSF- en serum S100B-spiegels verhoogd [199,202]. Meta-analyse (12 studies, 380 schizofrenie, 358 gezonde controles) bevestigde verhoogde serum S100B-spiegels bij schizofrenie [203]. In postmortale hersenen van personen met schizofrenie worden S100B-immunoreactieve astroglia gevonden in gebieden die betrokken zijn bij schizofrenie, waaronder de cortex anterior cingulate, dorsolaterale prefrontale cortex, orbitofrontale cortex en hippocampi [154]. Verhoogde S100B-niveaus correleren met paranoïde [154] en negativistische psychose [204], verminderde cognitie, slechte therapeutische respons en ziekteduur [202]. Genetische polymorfismen in S100B [32] en receptor voor geavanceerde glycatie-eindproductgenen in schizofreniecohorten (Tabel 2) [32,33,205] suggereren dat deze afwijkingen waarschijnlijk primair/pathogeen zijn in plaats van secundaire/biomarkers. Inderdaad, de afname van serum S100B-spiegels na behandeling met antidepressiva [201] en antipsychotica [196] suggereert�enige klinische relevantie van S100B voor de pathofysiologie van psychiatrische stoornissen.
Neuro-ontsteking en verhoogde oxidatieve stress
Oxidatieve stress is een aandoening waarbij een overmaat aan oxidanten biologische macromoleculen zoals lipiden, eiwitten en DNA beschadigt of wijzigt [206-209]. Deze overmaat is het gevolg van een verhoogde productie van oxidanten, verminderde eliminatie van oxidanten, een defecte antioxidantafweer of een combinatie daarvan [206-209]. De hersenen zijn bijzonder kwetsbaar voor oxidatieve stress als gevolg van: 1) verhoogde hoeveelheden peroxideerbare meervoudig onverzadigde vetzuren; 2) relatief hoog gehalte aan sporenelementen die lipideperoxidatie en zuurstofradicalen induceren (bijvoorbeeld ijzer, koper); 3) hoog zuurstofgebruik; en 3) beperkte anti-oxidatiemechanismen [206,207].
Overmatige oxidatieve stress kan optreden bij MDD [206], BPD [206,207], schizofrenie [207,209] en OCD [206,208]. Perifere markers van oxidatieve stoornissen zijn onder meer verhoogde lipideperoxidatieproducten (bijvoorbeeld malondialdehyde en 4-hydroxy-2-nonenal), verhoogde stikstofmonoxide (NO) metabolieten, verlaagde antioxidanten (bijvoorbeeld glutathion) en veranderde antioxidant-enzymniveaus [206,207].
Bij MDD correleert verhoogde superoxide-radicaal-anionproductie met verhoogde oxidatie-gemedieerde neutrofiele apoptose [206]. Serumspiegels van antioxidante enzymen (bijvoorbeeld superoxide dismutase-1) zijn verhoogd tijdens acute depressieve episodes en normaliseren na behandeling met selectieve serotonineheropnameremmers (SSRI's) [206]. Dit suggereert dat bij MDD serum antioxidant-enzymniveaus een toestandsmarker zijn, wat een compensatiemechanisme kan weerspiegelen dat acute toename van oxidatieve stress tegengaat. [206]. Bij schizofrenie daarentegen zijn CSF-oplosbare superoxide-dismutase-1-spiegels aanzienlijk verlaagd bij schizofrene patiënten met vroege aanvang in vergelijking met chronische schizofrene patiënten en gezonde controles. Dit suggereert dat verminderde niveaus van antioxidant-enzymen in de hersenen kunnen bijdragen aan oxidatieve schade bij acute schizofrenie [210], hoewel grotere studies nodig zijn om deze bevinding te bevestigen.
Verschillende aanvullende experimentele en menselijke studies onderzochten in meer detail de mechanismen die ten grondslag liggen aan de pathofysiologie van verhoogde oxidatieve stress bij psychiatrische stoornissen [206-262]. In diermodellen van depressie zijn de hersenniveaus van glutathion verlaagd, terwijl de lipideperoxidatie en NO-niveaus zijn verhoogd [206,262].
Postmortale onderzoeken tonen verlaagde hersenniveaus van totaal glutathion aan bij MDD, BPD [206] en schizofrene personen [206,207]. Fibroblasten gekweekt uit MDD-patiënten vertonen verhoogde oxidatieve stress onafhankelijk van glutathionniveaus [262], wat pleit tegen een primaire rol van glutathiondepletie als het belangrijkste mechanisme van oxidatieve stress bij depressie.
Microgliale activatie kan oxidatieve stress verhogen door de productie van pro-inflammatoire cytokines en NO [206-209]. Pro-inflammatoire cytokines en hoge NO-niveaus kunnen de vorming van reactieve zuurstofsoorten (ROS) bevorderen, wat op zijn beurt de lipideperoxidatie versnelt, membraanfosfolipiden en hun membraangebonden monoamine-neurotransmitterreceptoren beschadigen en endogene antioxidanten uitputten. Verhoogde ROS-producten kunnen de microgliale activering verbeteren en de pro-inflammatoire productie verhogen door NF-?B [208] te stimuleren, wat op zijn beurt oxidatieve schade [208] bestendigt, waardoor het potentieel ontstaat voor een pathologische positieve feedbacklus bij sommige psychiatrische stoornissen [206-209]. Hoewel neuro-inflammatie de glutamaatniveaus in de hersenen kan verhogen [85,86], blijft de rol van glutamaterge hyperactiviteit als oorzaak van oxidatieve stress onbewezen [207].
Mitochondriale disfunctie kan bijdragen aan verhoogde oxidatieve stress bij MDD, BPD en schizofrenie [206]. Postmortaal onderzoek naar deze aandoeningen onthult afwijkingen in mitochondriaal DNA, consistent met de hoge prevalentie van psychiatrische stoornissen bij primaire mitochondriale aandoeningen [206]. In vitro dierstudies tonen aan dat pro-inflammatoire cytokines, zoals TNF-?, de mitochondriale dichtheid kunnen verminderen en het mitochondriale oxidatieve metabolisme [211,212] kunnen schaden, wat leidt tot verhoogde ROS-productie [206,213]. Deze experimentele bevindingen kunnen mechanistische verbanden impliceren tussen neuro-inflammatie, mitochondriale disfunctie en oxidatieve stress [206,213], wat verder onderzoek verdient naar deze kruisende pathogene routes bij menselijke psychiatrische stoornissen.
De kwetsbaarheid van neuraal weefsel voor oxidatieve schade varieert tussen verschillende psychiatrische stoornissen op basis van de neuroanatomische, neurochemische en moleculaire routes die betrokken zijn bij de specifieke stoornis [207]. Behandelingseffecten kunnen ook van cruciaal belang zijn, aangezien voorlopig bewijs suggereert dat antipsychotica, SSRI's en stemmingsstabilisatoren antioxiderende eigenschappen hebben [206,207,262]. De therapeutische rol van adjuvante antioxidanten (bijvoorbeeld vitamine C en E) bij psychiatrische stoornissen moet nog worden onderbouwd door krachtige gerandomiseerde klinische onderzoeken. N-acetylcysteïne toont de meest veelbelovende resultaten tot nu toe, met verschillende gerandomiseerde placebogecontroleerde onderzoeken die de werkzaamheid ervan aantonen bij MDD, BPD en schizofrenie [207].
Bloed-hersenbarrière disfunctie
De BBB stelt de immuun-bevoorrechte status van de hersenen veilig door de toegang van perifere ontstekingsmediatoren te beperken, waaronder cytokinen en antilichamen die neurotransmissie kunnen schaden [214,215]. De hypothese van de afbraak van BBB en de rol ervan bij sommige psychiatrische patiënten [60,214,216,217] is consistent met de verhoogde prevalentie van psychiatrische comorbiditeit bij ziekten die verband houden met de disfunctie ervan, waaronder SLE [97], beroerte [11],�epilepsie [218] en auto-immuunencefalitiden (tabel 1). Een verhoogde �CSF:serum albumine ratio� bij patiënten met MDD en schizofrenie suggereert een verhoogde BBB-permeabiliteit [214].
In één onderzoek (63 psychiatrische proefpersonen, 4,100 controles) werden CSF-afwijkingen ontdekt die wijzen op BBB-schade bij 41% van de psychiatrische proefpersonen (14 MDD en BPD, 14 schizofrenie), waaronder intrathecale synthese van IgG, IgM en/of IgA, milde CSF-pleocytose (5 tot 8 cellen per mm3) en de aanwezigheid van maximaal vier IgG-oligoklonale banden [216]. Een post-mortem ultrastructureel onderzoek bij schizofrenie onthulde BBB-ultrastructurele afwijkingen in de prefrontale en visuele cortex, waaronder vacuolaire degeneratie van endotheelcellen, astrogliale-end-foot-processen, en verdikking en onregelmatigheid van de basale lamina [60]. In deze studie gaven de auteurs echter geen commentaar op de mogelijke bijdrage van postmortale veranderingen aan hun bevindingen. Een ander onderzoek naar transcriptomics van BBB-endotheelcellen in schizofrene hersenen identificeerde significante verschillen tussen genen die de immunologische functie beïnvloeden, die niet werden gedetecteerd in controles [217].
Door oxidatie gemedieerde endotheeldisfunctie kan bijdragen aan de pathofysiologie van BBB-disfunctie bij psychiatrische stoornissen. Indirect bewijs uit klinische en experimentele studies bij depressie [219] en, in mindere mate, bij schizofrenie [220] suggereert dat verhoogde oxidatie kan bijdragen aan endotheeldisfunctie. Endotheeldisfunctie kan een gedeeld mechanisme vertegenwoordigen dat verantwoordelijk is voor de bekende associatie tussen depressie en hart- en vaatziekten [219,221], die mogelijk verband houdt met verlaagde niveaus van vasodilatator NO [221-223]. Experimentele studies suggereren dat verlaagde endotheliale NO-niveaus mechanistisch gekoppeld zijn aan de ontkoppeling van endotheliaal stikstofmonoxidesynthase (eNOS) van zijn essentiële co-factor tetrahydrobiopterine (BH4), waardoor het substraat verschuift van L-arginine naar zuurstof [224-226]. Ongekoppelde eNOS bevordert de synthese van ROS (bijvoorbeeld superoxide) en reactieve stikstofsoorten (RNS) (bijvoorbeeld peroxynitriet; een product van de interactie van superoxide met NO) [227] in plaats van NO, wat leidt tot oxidatie-gemedieerde endotheeldisfunctie [ 224-226].
Diergegevens toonden aan dat SSRI's deficiënte endotheliale NO-niveaus kunnen herstellen [219], wat suggereert dat anti-oxidatieve mechanismen kunnen bijdragen aan hun antidepressieve effecten. Bij mensen kan L-methylfolaat de antidepressieve effecten van SSRI's [228] versterken, vermoedelijk door het verhogen van de niveaus van BH4, wat een essentiële cofactor is voor eNOS-re-koppeling-gemedieerde anti-oxidatie [229], evenals voor de snelheid -beperkende enzymen van de synthese van monoamine (dat wil zeggen serotonine, noradrenaline, dopamine) [228].
Alles bij elkaar genomen, zowel het recente werk dat de nadruk legt op de rol van niet-gekoppelde eNOS-geïnduceerde oxidatieve stress in de pathogenese van vaatziekten [230,231] als de...epidemiologische studies die depressie vaststellen als een onafhankelijke risicofactor voor vasculaire pathologieën, zoals beroerte en hartaandoeningen [219,221], voegen verdere ondersteuning toe aan de klinische relevantie van niet-gekoppelde eNOS-gemedieerde endotheliale oxidatieve schade bij depressie. Ondanks overvloedig bewijs voor cytokine-afwijkingen bij psychiatrische ziekten bij de mens en de experimentele gegevens die aantonen dat pro-inflammatoire cytokinen de expressie van eNOS [212] en de BBB-permeabiliteit [215] kunnen verhogen, is er humaan bewijs dat overtollige pro-inflammatoire cytokinen direct koppelt aan eNOS-disfunctie en/of BBB-stoornis. ontbrekend.
Beeldvorming en behandeling van ontstekingen bij psychiatrische aandoeningen
Beeldvorming van neuro-inflammatie in situ
Klinisch kan beeldvorming van neuro-inflammatie cruciaal blijken te zijn voor het identificeren van de subgroep van psychiatrische patiënten met neuro-inflammatie die het meest waarschijnlijk gunstig zouden reageren op immunomodulerende therapieën. Bovendien kan dergelijke beeldvorming clinici in staat stellen om neuro-inflammatie-gerelateerde ziekteactiviteit en de reactie op immuuntherapie bij psychiatrische patiënten te volgen. Het afbeelden van ontstekingen in het menselijk brein was traditioneel afhankelijk van MRI- of CT-visualisatie van extravagaat intraveneuze contrastmiddelen, wat wijst op gelokaliseerde afbraak van de BBB. Gadolinium-versterkte MRI toont af en toe een dergelijke afbraak in de limbische regio's geassocieerd met emotionele verwerking bij patiënten met psychiatrische stoornissen die kunnen worden toegeschreven aan paraneoplastische of andere encefalitiden [107,109,113]. Voor zover wij weten, is er echter nooit abnormale verbetering aangetoond bij een klassieke psychiatrische stoornis [21,214,232], ondanks functionele [214,216] en ultrastructurele BBB-afwijkingen [60].
Of subtielere neuro-inflammatie in vivo kan worden gevisualiseerd bij klassieke psychiatrische stoornissen, blijft onbekend. Een veelbelovende techniek is positronemissietomografie (PET) met behulp van radiotracers, zoals C11-PK11195, die binden aan het translocator-eiwit, voorheen bekend als de perifere benzodiazepinereceptor, tot expressie gebracht door geactiveerde microglia [233,234].
Met behulp van deze methode werd aangetoond dat patiënten met schizofrenie een grotere microgliale activatie hebben in de cortex [235] en in de hippocampus tijdens acute psychose [236]. Eén studie (14 schizofrenie, 14 controles) vond geen significant verschil tussen [11C] DAA1106-binding bij schizofrenie versus controles, maar een directe correlatie tussen [11C] DAA1106-binding en de ernst van positieve symptomen en ziekteduur bij schizofrenie [236].
Onderzoekers van onze instelling gebruikten C11-PK11195 PET om bi-hippocampale ontsteking aan te tonen bij een patiënt met neuropsychiatrische disfunctie, waaronder psychotische MDD, epilepsie en anterograde amnesie, geassocieerd met anti-GAD-antilichamen [237]. PK11195 PET heeft echterlage signaal-ruiseigenschappen en vereist een cyclotron ter plaatse.
Daarom wordt er onderzoek gedaan naar de ontwikkeling van verbeterde translocator-eiwitliganden voor PET en SPECT. Toekomstige krachtige post-mortem hersenweefselstudies die gebruik maken van eiwitkwantificering gericht op het ophelderen van metabole en inflammatoire routes, CNS-cytokines en hun bindende receptoren, bij psychiatrische stoornissen, zijn nodig om ons begrip van de auto-immuunpathofysiologie te vergroten.
De rol van ontstekingsremmende medicijnen bij psychiatrische stoornissen
Verschillende onderzoeken bij mensen en dieren suggereren dat bepaalde ontstekingsremmende geneesmiddelen een belangrijke aanvullende rol kunnen spelen bij de behandeling van psychiatrische stoornissen (tabel 3). Veel voorkomende medicijnen zijn cyclo-oxygenaseremmers (Tabel 3) [238-245], minocycline (Tabel 3) [240-245], omega-3-vetzuren [246,247] en neurosteroïden [248].
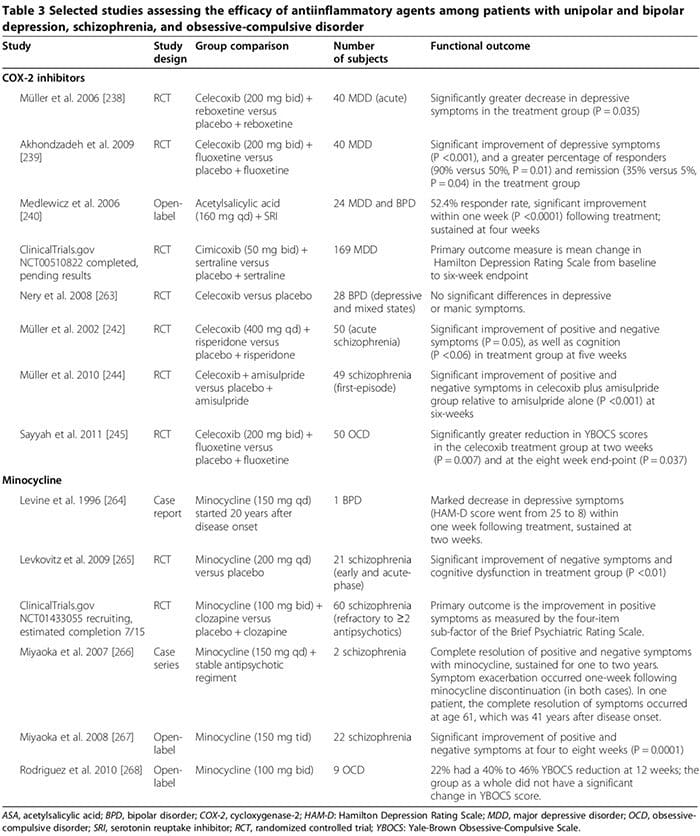 Verschillende onderzoeken bij mensen hebben aangetoond dat COX-2-remmers psychiatrische symptomen van MDD, BPD, schizofrenie en OCS kunnen verlichten (Tabel 3) [248]. Daarentegen kan adjuvante behandeling met niet-selectieve COX-remmers (dat wil zeggen niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)) de werkzaamheid van SSRI's verminderen [249,250]; twee grote onderzoeken meldden dat blootstelling aan NSAID's (maar niet aan selectieve COX-2-remmers of salicylaten) geassocieerd was met een significante verergering van depressie bij een subset van studiedeelnemers [249,250].
Verschillende onderzoeken bij mensen hebben aangetoond dat COX-2-remmers psychiatrische symptomen van MDD, BPD, schizofrenie en OCS kunnen verlichten (Tabel 3) [248]. Daarentegen kan adjuvante behandeling met niet-selectieve COX-remmers (dat wil zeggen niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)) de werkzaamheid van SSRI's verminderen [249,250]; twee grote onderzoeken meldden dat blootstelling aan NSAID's (maar niet aan selectieve COX-2-remmers of salicylaten) geassocieerd was met een significante verergering van depressie bij een subset van studiedeelnemers [249,250].
In het eerste onderzoek, waarbij 1,258 depressieve patiënten betrokken waren die gedurende 12 weken met citalopram werden behandeld, was de mate van remissie significant lager bij degenen die ten minste eenmaal NSAID's hadden gebruikt in vergelijking met degenen die dat niet hadden gedaan (45% versus 55%, OR 0.64, P = 0.0002) [249]. De andere studie, waarbij 1,545 MDD-proefpersonen betrokken waren, toonde aan dat het percentage therapieresistente depressie significant hoger was bij degenen die NSAID's gebruikten (OR 1.55, 95% BI 1.21 tot 2.00) [231]. De verergering van depressie in de NSAID-groepen is mogelijk niet mechanisch gekoppeld aan NSAID-therapie, maar is in plaats daarvan gerelateerd aan naast elkaar bestaande chronische medische aandoeningen [10,12-18] die langdurige NSAID's vereisen en waarvan bekend is dat ze onafhankelijk geassocieerd zijn met verhoogd risico op therapieresistente depressie [249,251]. Toekomstige studies die de impact van NSAID's op depressie en de respons op antidepressiva bij mensen onderzoeken, zijn nodig.
In andere experimentele onderzoeken waarbij gebruik werd gemaakt van paradigma's van acute stress om een depressie-achtige toestand bij muizen te induceren, verhoogde citalopram TNF-?, IFN-? en p11 (moleculaire factor gekoppeld aan depressief gedrag bij dieren) in de frontale cortex, terwijl de NSAID ibuprofen verminderde deze moleculen; NSAID's verzwakten ook de antidepressieve effecten van SSRI's, maar niet van andere antidepressiva [249]. Deze bevindingen suggereren dat pro-inflammatoire cytokines paradoxaal genoeg antidepressieve effecten kunnen uitoefenen, ondanks overweldigend bewijs van...studies bij mensen bewijzen het tegendeel (zoals hierboven besproken), wat kan worden afgezwakt door NSAID's [249]. Ten minste twee overwegingen kunnen deze schijnbare paradox verklaren: 1) onder sommige experimentele omstandigheden zijn pro-inflammatoire cytokinen in verband gebracht met een neuroprotectieve rol, [251; (voor�bijvoorbeeld IFN-? in lage niveaus kan neuroprotectieve microglia induceren (Figuur 2) [163,166,251]); en 2) of deze reacties waargenomen in de context van een acuut stressparadigma in een diermodel van toepassing zijn op endogene MDD bij mensen, blijft onduidelijk [251].
De therapeutische effecten van COX-2-remmers bij psychiatrische stoornissen kunnen modulatie van de biosynthese van van COX-2 afgeleide prostaglandinen omvatten, waaronder pro-inflammatoire PGE2 en anti-inflammatoire 15-deoxy-?12,14-PGJ2 (15d-PGJ2) [252,253]. COX-2-remmers kunnen PGE2-gemedieerde ontsteking verminderen, wat kan bijdragen aan de pathofysiologie van psychiatrische stoornissen [252,253]. Ze kunnen ook de niveaus 15d-PGJ2 en de activiteit van zijn nucleaire receptor peroxisoom proliferator-geactiveerde nucleaire receptor-gamma (PPAR-?) [252,253] veranderen.
Verschillende onderzoeken suggereren dat 15d-PGJ2 en zijn nucleaire receptor PPAR-? kunnen dienen als biologische markers voor schizofrenie [253]. Bij schizofrene patiënten zijn de serum-PGE2-spiegels verhoogd, terwijl de serumspiegels van 15d-PGJ2 zijn verlaagd, evenals de expressie van zijn nucleaire receptor PPAR-? in PBMC [252]. Hoewel COX-2-remmers de potentieel gunstige anti-inflammatoire effecten van de COX-2-afhankelijke 15d-PGJ2/PPAR-? route�, kunnen ze met voordeel de schadelijke effecten ervan verminderen, waaronder 1) het verhoogde risico op een hartinfarct en bepaalde infecties (bijvoorbeeld cytomegalovirus en Toxoplasma gondii) bij schizofrene patiënten [254] en 2) de pro-apoptotische effecten die zijn waargenomen bij menselijk en dierlijk kankerweefsel [255]. Andere potentiële mechanismen van therapeutische effecten van COX-2-remmers kunnen hun vermogen omvatten om pro-inflammatoire cytokineniveaus [163] te verlagen, chinolinezuur-excitotoxiciteit te beperken (zoals bij MDD) en KYNA-niveaus te verlagen (zoals bij schizofrenie) [128].
Minocycline kan effectief zijn bij psychiatrische stoornissen (Tabel 3) [248]. In vitro-gegevens suggereren dat minocycline MAP, cytokinesecretie, COX-2/PGE-2-expressie en induceerbaar stikstofoxidesynthase [256] remt. Minocycline kan ook ontregelde glutamaterge en dopaminerge neurotransmissie tegengaan [256].
De effectiviteit van omega-3 vetzuren bij psychiatrische stoornissen is onduidelijk [248]. In een meta-analyse uit 2011 van 15 gerandomiseerde gecontroleerde onderzoeken (916 MDD) verminderden omega-3-supplementen die eicosapentaeenzuur ?60% (dosisbereik 200 tot 2,200 mg/d hoger dan de dosis docosahexaeenzuur) significant depressieve symptomen als een aanvullende therapie bij SRI's (P <0.001) [246]. Een daaropvolgende meta-analyse concludeerde echter dat er geen significant voordeel is van omega-3-vetzuren bij depressie en dat de beweerde werkzaamheid slechts een gevolg is van publicatiebias [247]. Een meta-analyse uit 2012 van 5 gerandomiseerde gecontroleerde onderzoeken, waaronder 291 BPS-deelnemers, vond dat depressieve, maar niet manische symptomen significant verbeterden bij degenen die waren gerandomiseerd naar omega-3-vetzuren in vergelijking met degenen die placebo gebruikten (Hedges g 0.34, P = 0.025) [257]. In een gerandomiseerde gecontroleerde studie van schizofrene proefpersonen, gevolgd tot 12 maanden, waren zowel positieve als negatieve symptoomscores significant verminderd onder de 66 deelnemers die waren gerandomiseerd naar lange-keten omega-3 (1.2 g/dag gedurende 12 weken; P = 0.02 en 0.01, respectievelijk) [258]; de�auteurs concludeerden dat omega-3-vergroting tijdens het vroege beloop van schizofrenie ook terugval en ziekteprogressie kan voorkomen [258].
Een meta-analyse uit 2012 van zeven gerandomiseerde gecontroleerde onderzoeken waarin omega-3-augmentatie bij 168 schizofrene patiënten werd beoordeeld, vond geen voordeel van de behandeling [259]. De auteurs van deze meta-analyse gaven specifiek aan dat er geen conclusie kon worden getrokken met betrekking tot de terugvalpreventie of ziekteprogressie-eindpunten [259]. Experimentele gegevens suggereren dat eicosapentaeenzuur en docosahexaeenzuur hun ontstekingsremmende effecten mediëren door de synthese van resolvins en protectines te bevorderen, die de infiltratie van leukocyten kunnen remmen en de productie van cytokines kunnen verminderen [248].
Neurosteroïden, waaronder pregnenolone en zijn stroomafwaartse metaboliet allopregnanolone, kunnen een gunstige rol spelen bij sommige psychiatrische stoornissen [248,260]. Bij MDD vonden verschillende onderzoeken verlaagde allopregnanolonspiegels in plasma/CSF die correleerden met de ernst van de symptomen, die normaliseerden na succesvolle behandeling met bepaalde antidepressiva (bijvoorbeeld SSRI's) en elektroconvulsietherapie [261]. Bij schizofrenie kunnen de pregnenolonspiegels in de hersenen veranderen [248] en de serumspiegels van allopregnanolon kunnen stijgen na sommige antipsychotica (bijvoorbeeld clozapine en olanzapine) [260]. In drie gerandomiseerde gecontroleerde onderzoeken (100 schizofrenie (gepoold); behandelingsduur ongeveer negen weken) waren positieve, negatieve en cognitieve symptomen, evenals extrapiramidale bijwerkingen van antipsychotica significant verbeterd in een of meer onderzoeken onder degenen die waren gerandomiseerd naar pregnenolone vergeleken met degenen die placebo kregen [248]. In één onderzoek hield de verbetering aan bij langdurige behandeling met pregnenolone [248]. Pregnenolone kan cognitie en gedrag reguleren door de functie van NMDA- en GABAA-receptoren te versterken [248]. Bovendien kan allopregnanolone neuroprotectieve en ontstekingsremmende effecten uitoefenen [248]. Er zijn meer RCT-onderzoeken nodig om de gunstige rol van neuroactieve steroïden bij vroege psychiatrische stoornissen bij mensen te bevestigen.
We wachten op de resultaten van verschillende lopende klinische onderzoeken naar de therapeutische effecten van andere ontstekingsremmende middelen, waaronder salicylaat, een remmer van NF-KB (NCT01182727); acetylsalicylzuur (NCT01320982); pravastatine (NCT1082588); en dextromethorfan, een niet-competitieve NMDAR-antagonist die door ontsteking veroorzaakte dopaminerge neuronale schade kan beperken (NCT01189006).
Toekomstige behandelstrategieën
Hoewel de huidige immuuntherapieën (bijvoorbeeld IVIG, plasmaferese, corticosteroïden en immunosuppressiva) vaak effectief zijn voor de behandeling van auto-immuunencefalitiden waarbij de ontsteking acuut, intens en voornamelijk van adaptieve oorsprong is, is hun werkzaamheid bij klassieke psychiatrische stoornissen waarbij de ontsteking chronisch is,�veel milder, en voornamelijk van aangeboren oorsprong, is beperkt [2]. De ontwikkeling van nieuwe therapieën moet gericht zijn op het omkeren van gliaverlies [46,138], het neerwaarts reguleren van schadelijke MAP, terwijl endogene neuroprotectieve T-regs en gunstige MAP worden geoptimaliseerd, in plaats van lukraak ontstekingen te onderdrukken zoals gebeurt met de huidige immunosuppressiva. Bovendien is de ontwikkeling van krachtige co-adjuvante antioxidanten nodig die oxidatieve schade bij psychiatrische stoornissen zouden omkeren.
Conclusies
Auto-immuniteit kan een groot aantal neuropsychiatrische stoornissen veroorzaken die zich aanvankelijk kunnen voordoen met geïsoleerde psychiatrische symptomen. Aangeboren ontsteking/auto-immuniteit kan relevant zijn voor de pathogenese van psychiatrische symptomen bij een subgroep van patiënten met klassieke psychiatrische stoornissen. Aangeboren ontsteking kan mechanisch gekoppeld zijn aan de traditionele monoaminerge en glutamaterge afwijkingen en verhoogde oxidatieve schade die wordt gemeld bij psychiatrische aandoeningen.
Souhel Najjar1,5*, Daniel M Pearlman2,5, Kenneth Alper4, Amanda Najjar3 en Orrin Devinsky1,4,5
Afkortingen
3-OH-KYN: 3-hydroxy-kynurenine; ?7nAchR: Alpha 7 nicotine acetylcholine receptoren; AMPAR: Amino-3-hydroxy-5-methyl-l-4-isoxazoolpropionzuurreceptoren; APC: antigeenpresenterende cel; BBB: Bloed-hersenbarrière;
BH4: tetrahydrobiopterine; BPS: bipolaire stoornis; CI: Betrouwbaarheidsinterval;
CNS: Centraal zenuwstelsel; COX-2: Cyclooxegenase-2; CSF: hersenvocht; DSM-IV: diagnostische en statistische handleiding voor psychische stoornissen 4e editie; EAAT's: exciterende aminozuurtransporters; eNOS: endotheliaal stikstofoxidesynthase; GABAB: Gamma-aminoboterzuur-bèta; GAD: glutaminezuurdecarboxylase; GFAP: gliaal fibrillair zuur eiwit; GLX: 1H MRS detecteerbaar glutamaat, glutamine, gamma-aminoboterzuurcomposiet;
IDO: Indoleamine 2,3-dioxygenase; Ig: immunoglobuline; IL: Interleukine; IL-1RA: Interleukine-1-receptorantagonist; IFN-?: Interferon-gamma;
KAT: Kynurenine-aminotransferase; KMO: Kynurenine-3-monooxygenase; KYN: Kynurenine; KYNA: Kynureenzuur; LE: limbische encefalitis;
LPS: Lipopolysacharide; MAP: Microgliale activatie en proliferatie;
MDD: depressieve stoornis; mGluR: Metabotrope glutamaatreceptor; MHC: II Major histocompatibiliteitscomplex klasse twee; MRI: magnetische resonantie beeldvorming; MRS: Magnetische resonantiespectroscopie; NF-KB: Nucleaire factor kappa B; NMDAR: N-methyl-D-aspartaatreceptor; NR1: Glycineplaats;
OCS: obsessief-compulsieve stoornis; OF: Odds-ratio; PANDAS: pediatrische neuropsychiatrische auto-immuunziekten geassocieerd met streptokokkeninfecties; PBMC: mononucleaire cellen uit perifeer bloed; PET: positronemissietomografie; PFC: Prefrontale cortex; PGE-2: prostaglandine E2; PPAR-
?: Peroxisoom-proliferator-geactiveerde nucleaire receptor-gamma; QA: Chinolinezuur; RNS: reactieve stikstofsoorten; ROS: reactieve zuurstofsoorten;
sIL: Oplosbaar interleukine; SLE: systemische lupus erythematodes; SRI: serotonineheropnameremmer; TNF-?: Tumornecrosefactor-alfa; T-regs: CD4+CD25 +FOXP3+ T-regulerende cellen; TDO: Tryptofaan-2,3-dioxygenase; Th: T-helper; VGKC: Spanningsafhankelijk kaliumkanaal; XAG-: glutamaat aspartaat transporteur; Xc-: natriumonafhankelijk astrogliaal glutamaat/cystine
antiporter systeem
Concurrerende belangen
De auteurs verklaren dat ze geen concurrerende belangen hebben.
Auteurs��Bijdragen
SN en DMP voerden een uitgebreide literatuurstudie uit, interpreteerden gegevens, bereidden het manuscript, figuren en tabellen voor. KA bereidde de sectie met betrekking tot oxidatieve mechanismen voor en droeg bij aan de manuscriptrevisies. AN en OD hebben het ontwerp en de kwaliteit van het manuscript kritisch herzien en verbeterd. Alle auteurs hebben het definitieve manuscript gelezen en goedgekeurd.
Dankwoord
Met dank erkennen wij Drs. Josep Dalmau, MD, PhD, Tracy Butler, MD, en David Zazag, MD, PhD, voor het verstrekken van hun expertise in respectievelijk auto-immuun encefalitiden, beeldvorming van neuro-inflammatie en neuropathologie.
Auteur�Details
1 Afdeling Neurologie, New York University School of Medicine, 550 First Avenue, New York, NY 10016, VS. 2Geisel School of Medicine in Dartmouth, The Dartmouth Institute for Health Policy and Clinical Practice, 30 Lafayette Street, HB 7252, Libanon, NH 03766, VS. 3 Afdeling Pathologie, Afdeling Neuropathologie, New York University School of Medicine, 550 First Avenue, New York, NY 10016, VS. 4Afdeling Psychiatrie, New York University School of Medicine, New York, NY, VS. 5 New York University Comprehensive Epilepsy Center, 550 First Avenue, New York, NY 10016, VS.
Blanco
Referenties:
1. Kayser MS, Dalmau J: de opkomende link tussen auto-immuunziekten
en neuropsychiatrische aandoeningen. J Neuropsychiatrie Clin Neurosci 2011, 23:90-97.
2. Najjar S, Pearlman D, Zagzag D, Golfinos J, Devinsky O: glutaminezuur
decarboxylase-auto-antilichaamsyndroom dat zich presenteert als schizofrenie.
Neuroloog 2012, 18:88-91.
3. Graus F, Saiz A, Dalmau J: Antilichamen en neuronale auto-immuunziekten
aandoeningen van het CZS. J Neurol 2010, 257:509.
4. Lennox BR, Coles AJ, Vincent A: Antilichaam-gemedieerde encefalitis: a
behandelbare oorzaak van schizofrenie. Br J Psychiatrie 2012, 200:92-94.
5. Zandi MS, Irani SR, Lang B, Waters P, Jones PB, McKenna P, Coles AJ, Vincent
A, Lennox BR: Ziekte-relevante auto-antilichamen in eerste aflevering
schizofrenie. J Neurol 2011, 258:686-688.
6. Bataller L, Kleopa KA, Wu GF, Rossi JE, Rosenfeld MR, Dalmau J:
Auto-immuun limbische encefalitis bij 39 patiënten: immunofenotypes en
uitkomsten. J Neurol Neurosurg Psychiatry 2007, 78:381-385.
7. Dale RC, Heyman I, Giovannoni G, Church AW: Incidentie van anti-hersenen
antistoffen bij kinderen met een obsessief-compulsieve stoornis. Br J Psychiatrie
2005, 187:314-319.
8. Kendler KS: De gevlekte aard van oorzaken van psychiatrische aandoeningen: vervanging
de dichotomie organisch-functioneel/hardware-software met empirisch
gebaseerd pluralisme. Mol Psychiatrie 2012, 17:377.
9. Keskin G, Sunter G, Midi I, Tuncer N: Neurosyfilis als oorzaak van cognitieve
achteruitgang en psychiatrische symptomen op jongere leeftijd. J Neuropsychiatrie kliniek
Neurosci 2011, 23:E41-E42.
10. Leboyer M, Soreca I, Scott J, Frye M, Henry C, Tamouza R, Kupfer DJ: Kan
bipolaire stoornis worden gezien als een multi-systeem ontstekingsziekte?
J Affectstoornis 2012, 141:1�10.
11. Hackett ML, Yapa C, Parag V, Anderson CS: frequentie van depressie na
beroerte: een systematische review van observationele studies. Beroerte 2005, 36:1330-1340.
12. Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW: van
ontsteking tot ziekte en depressie: wanneer het immuunsysteem
onderwerpt de hersenen. Nat Rev Neurosci 2008, 9:46-56.
13. Laske C, Zank M, Klein R, Stransky E, Batra A, Buchkremer G, Schott K:
Auto-antilichaamreactiviteit in serum van patiënten met ernstige depressie,
schizofrenie en gezonde controles. Psychiatrie Res 2008, 158:83-86.
14. Eisenberger NI, Berkman ET, Inagaki TK, Rameson LT, Mashal NM, Irwin MR:
Door ontsteking veroorzaakte anhedonie: endotoxine vermindert het ventrale striatum
reacties op beloning. Biol Psychiatry 2010, 68:748.
15. Haroon E, Raison CL, Miller AH: Psychoneuroimmunology komt samen
neuropsychofarmacologie: translationele implicaties van de impact van
ontsteking op gedrag. Neuropsychofarmacologie 2012, 37:137-162.
16. Benros ME, Nielsen PR, Nordentoft M, Eaton WW, Dalton SO, Mortensen PB:
Auto-immuunziekten en ernstige infecties als risicofactoren voor:
schizofrenie: een 30-jarige populatiegebaseerd registeronderzoek. Ben J Psychiatrie
2011, 168:1303-1310.
17. McNally L, Bhagwagar Z, Hannestad J: Ontsteking, glutamaat en glia
bij depressie: een literatuuroverzicht. CNS Spectr 2008, 13:501�510.
18. Harrison NA, Brydon L, Walker C, Grey MA, Steptoe A, Critchley HD:
Ontsteking veroorzaakt stemmingswisselingen door veranderingen in subgenual
cingulate activiteit en mesolimbische connectiviteit. Biol Psychiatrie 2009,
66:407. Raison CL, Miller AH: Is depressie een inflammatoire aandoening?
Curr Psychiatry Rep 2011, 13:467.
20. Raison CL, Miller AH: De evolutionaire betekenis van depressie bij
Pathogen Host Defense (PATHOS-D). Mol Psychiatrie 2013, 18:15�37.
21. Steiner J, Bogerts B, Sarnyai Z, Walter M, Gos T, Bernstein HG, Myint AM:
De kloof overbruggen tussen de immuun- en glutamaathypothesen van
schizofrenie en ernstige depressie: mogelijke rol van gliale NMDA
receptormodulatoren en verminderde integriteit van de bloed-hersenbarrière. Wereld J
Biol Psychiatry 2012, 13:482.
22. Steiner J, Mawrin C, Ziegeler A, Bielau H, Ullrich O, Bernstein HG, Bogerts B:
Verdeling van HLA-DR-positieve microglia bij schizofrenie weerspiegelt
verminderde cerebrale lateralisatie. Acta Neuropathie 2006, 112:305-316.
23. Papakostas GI, Shelton RC, Kinrys G, Henry ME, Bakow BR, Lipkin SH, Pi B,
Thurmond L, Bilello JA: Beoordeling van een multi-assay, op serum gebaseerd
biologische diagnostische test voor depressieve stoornis: een pilot en
replicatie studie. Mol Psychiatrie 2013, 18:332-339.
24. Krishnan R: Unipolaire depressie bij volwassenen: epidemiologie, pathogenese en
neurobiologie. Bij UpToDate. Bewerkt door Basow DS. Waltham, MA: UpToDate; 2013.
25. Stovall J: bipolaire stoornis bij volwassenen: epidemiologie en diagnose. In
Actueel. Bewerkt door Basow DS. UpToDate: Waltham; 2013.
26. Fischer BA, Buchanan RW: Schizofrenie: epidemiologie en pathogenese.
Bij UpToDate. Bewerkt door Basow DS. Waltham, MA: UpToDate; 2013.
27. Nestadt G, Samuels J, Riddle M, Bienvenu OJ 3rd, Liang KY, LaBuda M,
Walkup J, Grados M, Hoehn-Saric R: een familiestudie van obsessief-compulsief
wanorde. Arch Gen Psychiatry 2000, 57: 358-363.
28. Stefansson H, Ophoff RA, Steinberg S, Andreassen OA, Cichon S, Rujescu D,
Werge T, Pietilainen OP, Mors O, Mortensen PB, Sigurdsson E, Gustafsson O,
Nyegaard M, Tuulio-Henriksson A, Ingason A, Hansen T, Suvisaari J,
Lonnqvist J, Paunio T, Bérglum AD, Hartmann A, Fink-Jensen A, Nordentoft
M, Hougaard D, Norgaard-Pedersen B, Büttcher Y, Olesen J, Breuer R, Müller
HJ, Giegling I, et al: Veel voorkomende varianten die het risico op schizofrenie met zich meebrengen.
Natuur 2009, 460:744.
29. Müller N, Schwarz MJ: de immuungemedieerde verandering van serotonine en
glutamaat: naar een geïntegreerde kijk op depressie. Mol Psychiatrie
2007, 12:988-1000.
30. Galecki P, Florkowski A, Bienkiewics M, Szemraj J: Functioneel polymorfisme
van het cyclo-oxygenase-2-gen (G-765C) bij depressieve patiënten.
Neuropsychobiologie 2010, 62:116-120.
31. Levinson DF: de genetica van depressie: een overzicht. Biol Psychiatrie 2006,
60: 84.
32. Zhai J, Cheng L, Dong J, Shen Q, Zhang Q, Chen M, Gao L, Chen X, Wang K,
Deng X, Xu Z, Ji F, Liu C, Li J, Dong Q, Chen C: S100B-gen
polymorfismen voorspellen prefrontale ruimtelijke functie bij beide schizofrenie
patiënten en gezonde individuen. Schizophr Res 2012, 134:89-94.
33. Zhai J, Zhang Q, Cheng L, Chen M, Wang K, Liu Y, Deng X, Chen X, Shen Q,
Xu Z, Ji F, Liu C, Dong Q, Chen C, Li J: risicovarianten in het S100B-gen,
geassocieerd met verhoogde S100B-spiegels, zijn ook geassocieerd met:
visueel-ruimtelijke handicap van schizofrenie. Gedrag Brain Res 2011, 217:363-368.
34. Cappi C, Muniz RK, Sampaio AS, Cordeiro Q, Brentani H, Palacios SA,
Marques AH, Vallada H, Miguel EC, Guilherme L, Hounie AG: Vereniging
studie tussen functionele polymorfismen in het TNF-alfa-gen en
obsessief-compulsieve stoornis. Arq Neuropsiquiatr 2012, 70:87-90.
35. Miguel-Hidalgo JJ, Baucom C, Dilley G, Overholser JC, Meltzer HY,
Stockmeier CA, Rajkowska G: Glial fibrillair zuur eiwit
immunoreactiviteit in de prefrontale cortex onderscheidt jongere van
oudere volwassenen met een depressieve stoornis. Biol Psychiatry 2000, 48:861.
36. Altshuler LL, Abulseoud OA, Foland Ross L, Bartzokis G, Chang S, Mintz J,
Hellemann G, Vinters HV: Amygdala-astrocytenreductie bij proefpersonen met
depressieve stoornis, maar geen bipolaire stoornis. Bipolaire stoornis 2010,
12: 541.
37. Webster MJ, Knable MB, Johnston-Wilson N, Nagata K, Inagaki M, Yolken RH:
Immunohistochemische lokalisatie van gefosforyleerd gliaal fibrillair zuur
eiwit in de prefrontale cortex en hippocampus van patiënten met
schizofrenie, bipolaire stoornis en depressie. Hersengedrag Immun 2001,
15: 388.
38. Doyle C, Deakin JFW: minder astrocyten in de frontale cortex bij schizofrenie,
depressie en bipolaire stoornis. Schizofrenie Res 2002, 53:106.
39. Johnston-Wilson NL, Sims CD, Hofmann JP, Anderson L, Shore AD, Torrey
EF, Yolken RH: Ziektespecifieke veranderingen in herseneiwitten in de frontale cortex
bij schizofrenie, bipolaire stoornis en depressieve stoornis, The
Stanley Neuropathologie Consortium. Mol Psychiatrie 2000, 5:142-149.
40. Gosselin RD, Gibney S, O'Malley D, Dinan TG, Cryan JF: regiospecifiek
afname van de immunoreactiviteit van gliaal fibrillair zuur eiwit in de hersenen van
een rattenmodel van depressie. Neurowetenschap 2009, 159:915.
41. Banasr M, Duman RS: gliaverlies in de prefrontale cortex is voldoende om
depressief gedrag veroorzaken. Biol Psychiatry 2008, 64:863.
42. Cotter D, Hudson L, Landau S: bewijs voor orbitofrontale pathologie in
bipolaire stoornis en ernstige depressie, maar niet bij schizofrenie.
Bipolaire stoornis 2005, 7:358.
43. Brauch RA, Adnan El-Masri M, Parker J Jr, El-Mallakh RS: gliacelaantal
en verhoudingen van neuronen/gliacellen in postmortale hersenen van bipolaire individuen.
J Affectstoornis 2006, 91:87�90.
44. Cotter DR, Pariante CM, Everall IP: gliacelafwijkingen in grote
psychiatrische stoornissen: het bewijs en de implicaties. Hersenen Res Bull 2001,
55: 585.
45. Cotter D, Mackay D, Landau S, Kerwin R, Everall I: verminderde gliaceldichtheid
en neuronale grootte in de cortex anterior cingulate bij depressieve
wanorde. Arch Gen Psychiatry 2001, 58: 545-553.
46. Bowley MP, Drevets WC, Ong�r D, Prijs JL: Lage gliale getallen in de
amygdala bij depressieve stoornis. Biol Psychiatry 2002, 52:404.
47. Toro CT, Hallak JE, Dunham JS, Deakin JF: Glial fibrillair zuur eiwit en
glutaminesynthetase in subregio's van de prefrontale cortex bij schizofrenie
en stemmingsstoornis. Neurosci Lett 2006, 404:276.
48. Rajkowska G, Miguel-Hidalgo JJ, Makkos Z, Meltzer H, Overholser J,
Stockmeier C: Laagspecifieke reducties in GFAP-reactieve astroglia in de
dorsolaterale prefrontale cortex bij schizofrenie. Schizophr Res 2002, 57:127-138.
49. Steffek AE, McCullumsmith RE, Haroutunian V, Meador-Woodruff JH: Corticaal
expressie van gliaal fibrillair zuur eiwit en glutaminesynthetase is
afgenomen bij schizofrenie. Schizophr Res 2008, 103:71-82.
50. Damadzic R, Bigelow LB, Krimer LS, Goldenson DA, Saunders RC, Kleinman
JE, Herman MM: een kwantitatieve immunohistochemische studie van astrocyten in
de entorhinale cortex bij schizofrenie, bipolaire stoornis en major
depressie: afwezigheid van significante astrocytose. Brain Res Bull 2001, 55:611.
51. Benes FM, McSparren J, Bird ED, SanGiovanni JP, Vincent SL: Tekorten in
kleine interneuronen in prefrontale en cingulate cortex van schizofreen
en schizoaffectieve patiënten. Arch Gen Psychiatry 1991, 48:996-1001.
52. Müller N, Schwarz MJ: Immuunsysteem en schizofrenie. Curr Immunol
Rev 2010, 6:213-220.
53. Steiner J, Walter M, Gos T, Guillemin GJ, Bernstein HG, Sarnyai Z, Mawrin C,
Brisch R, Bielau H, Meyer Zu Schwabedissen L, Bogerts B, Myint AM: Ernstig
depressie is geassocieerd met verhoogde microgliale chinolinezuur in
subregio's van de anterior cingulate gyrus: bewijs voor een immuungemoduleerde
glutamaterge neurotransmissie? J Neuro-ontsteking 2011, 8:94.
54. Vostrikov VM, Uranova NA, Orlovskaya DD: tekort aan perineuronal
oligodendrocyten in de prefrontale cortex bij schizofrenie en stemming
aandoeningen. Schizophr Res 2007, 94: 273-280.
55. Rajkowska G, Miguel-Hidalgo JJ: Gliogenese en gliale pathologie in
depressie. CNS Neurol Disord Drug Targets 2007, 6:219-233.
56. Uranova NA, Vostrikov VM, Orlovskaya DD, Rachmanova VI:
Oligodendrogliale dichtheid in de prefrontale cortex bij schizofrenie en
stemmingsstoornissen: een onderzoek van het Stanley Neuropathology Consortium.
Schizophr Res 2004, 67: 269-275.
57. Uranova N: Schade en verlies van oligodendrocyten zijn cruciaal in de
pathogenese van schizofrenie en stemmingsstoornissen (bevindingenformulier
postmortaal onderzoek). Neuropsychofarmacologie 2004, 29:S33.
58. Uranova NA, Orlovskaya DD, Vostrikov VM, Rachmanova VI: afgenomen
dichtheid van oligodendrogliale satellieten van piramidale neuronen in laag III in
de prefrontale cortex bij schizofrenie en stemmingsstoornissen. Schizofret onderzoek
2002/53/107, XNUMX:XNUMX uur.
59. Vostrikov VM, Uranova NA, Rakhmanova VI, Orlovskaia DD: verlaagd
oligodendrogliale celdichtheid in de prefrontale cortex bij schizofrenie.
Zh Nevrol Psikhiatr Im SS Korsakova 2004, 104:47-51.
60. Uranova NA, Zimina IS, Vikhreva OV, Krukov NO, Rachmanova VI, Orlovskaja
DD: Ultrastructurele schade aan haarvaten in de neocortex in
schizofrenie. Wereld J Biol Psychiatry 2010, 11:567.
61. Hof PR, Haroutunian V, Friedrich VL Jr, Byne W, Buitron C, Perl DP, Davis KL:
Verlies en veranderde ruimtelijke verdeling van oligodendrocyten in de superieure
frontale gyrus bij schizofrenie. Biol Psychiatry 2003, 53:1075-1085.
62. Davis KL, Stewart DG, Friedman JI, Buchsbaum M, Harvey PD, Hof PR,
Buxbaum J, Haroutunian V: Veranderingen in de witte stof bij schizofrenie:
bewijs voor myeline-gerelateerde disfunctie. Arch Gen Psychiatrie 2003,
60:443�456.63. Flynn SW, Lang DJ, Mackay AL, Goghari V, Vavasour IM, Whittall KP, Smith
GN, Arango V, Mann JJ, Dwork AJ, Falkai P, Honer WG: afwijkingen van
myelinisatie bij schizofrenie gedetecteerd in vivo met MRI, en postmortem
met analyse van oligodendrocyteiwitten. Mol Psychiatrie 2003,
8: 811.
64. Uranova NA, Vostrikov VM, Vikhreva OV, Zimina IS, Kolomeets NS, Orlovskaya
DD: De rol van oligodendrocytpathologie bij schizofrenie. Int J
Neuropsychopharmacol 2007, 10:537.
65. Byne W, Kidkardnee S, Tatusov A, Yiannoulos G, Buchsbaum MS,
Haroutunian V: Schizofrenie-geassocieerde vermindering van neuronale en
aantal oligodendrocyten in de voorste belangrijkste thalamische kern.
Schizophr Res 2006, 85: 245-253.
66. Hamidi M, Drevets WC, Price JL: Glial reductie in amygdala in major
depressieve stoornis wordt veroorzaakt door oligodendrocyten. Biol Psychiatrie 2004,
55: 563.
67. Bayer TA, Buslei R, Havas L, Falkai P: bewijs voor activering van microglia in
patiënten met psychiatrische aandoeningen. Neurosci Lett 1999, 271:126.
68. Steiner J, Bielau H, Brisch R, Danos P, Ullrich O, Mawrin C, Bernstein HG,
Bogerts B: Immunologische aspecten in de neurobiologie van zelfmoord:
verhoogde microgliale dichtheid bij schizofrenie en depressie is
geassocieerd met zelfmoord. J Psychiatr Res 2008, 42:151.
69. Rao JS, Harry GJ, Rapoport SI, Kim HW: verhoogde excitotoxiciteit en
neuro-inflammatoire markers in postmortale frontale cortex van bipolaire
stoornis patiënten. Mol Psychiatrie 2010, 15:384.
70. Bernstein HG, Steiner J, Bogerts B: gliacellen bij schizofrenie:
pathofysiologische betekenis en mogelijke gevolgen voor therapie.
Expert Rev Neurother 2009, 9:1059-1071.
71. Chen SK, Tvrdik P, Peden E, Cho S, Wu S, Spangrude G, Capecchi MR:
Hematopoëtische oorsprong van pathologische verzorging bij Hoxb8-mutante muizen.
Cel 2010, 141:775�785.
72. Antony JM: Verzorgen en groeien met microglia. Sci-signaal 2010, 3:jc8.
73. Wonodi I, Stine OC, Sathyasaikumar KV, Roberts RC, Mitchell BD, Hong LE,
Kajii Y, Thaker GK, Schwarcz R: gedownreguleerde kynurenine 3-
monooxygenase-genexpressie en enzymactiviteit bij schizofrenie
en genetische associatie met schizofrenie-endofenotypes. boog Gen
Psychiatrie 2011, 68:665.
74. Raison CL, Lowry CA, Rook GA: ontsteking, sanitaire voorzieningen en
consternatie: verlies van contact met co-evolved, tolerogene
micro-organismen en de pathofysiologie en behandeling van major
depressie. Arch Gen Psychiatry 2010, 67:1211-1224.
75. Drexhage RC, Hoogenboezem TH, Versnel MA, Berghout A, Nolen WA,
Drexhage HA: de activering van monocyten- en T-celnetwerken bij patiënten
met een bipolaire stoornis. Brain Behav Immun 2011, 25: 1206-1213.
76. Steiner J, Jacobs R, Panteli B, Brauner M, Schiltz K, Bahn S, Herberth M,
Westphal S, Gos T, Walter M, Bernstein HG, Myint AM, Bogerts B: acuut
schizofrenie gaat gepaard met verminderde T-cel en verhoogde B-cel
immuniteit. Eur Arch Psychiatry Clin Neurosci 2010, 260:509.
77. Rotge JY, Aouizerate B, Tignol J, Bioulac B, Burbaud P, Guehl D: De
op glutamaat gebaseerde genetische immuunhypothese in obsessief-compulsieve
stoornis, een integrale benadering van genen tot symptomen.
Neurowetenschappen 2010, 165:408-417.
78. Y�ksel C, Ong�r D: Magnetische resonantiespectroscopiestudies van
glutamaat-gerelateerde afwijkingen bij stemmingsstoornissen. Biol Psychiatrie 2010,
68: 785.
79. Rao JS, Kellom M, Reese EA, Rapoport SI, Kim HW: ontregeld glutamaat
en dopaminetransporters in postmortale frontale cortex van bipolaire
en schizofrene patiënten. J Affect Disord 2012, 136:63-71.
80. Bauer D, Gupta D, Harotunian V, Meador-Woodruff JH, McCullumsmith RE:
Abnormale expressie van glutamaattransporter en transporter
interagerende moleculen in de prefrontale cortex bij oudere patiënten met
schizofrenie. Schizophr Res 2008, 104:108-120.
81. Matute C, Melone M, Vallejo-Illarramendi A, Conti F: verhoogde expressie
van de astrocytische glutamaattransporter GLT-1 in de prefrontale cortex van
schizofrenen. 2005, 49:451-455.
82. Smith RE, Haroutunian V, Davis KL, Meador-Woodruff JH: uitdrukking van
excitatoire aminozuurtransportertranscripten in de thalamus van proefpersonen
met schizofrenie. Am J Psychiatry 2001, 158:1393-1399.
83. McCullumsmith RE, Meador-Woodruff JH: Striataal exciterend aminozuur
expressie van transportertranscripten bij schizofrenie, bipolaire stoornis,
en ernstige depressieve stoornis. Neuropsychofarmacologie 2002,
26: 368.
84. Pittenger C, Bloch MH, Williams K: Glutamaatafwijkingen bij obsessieve
compulsieve stoornis: neurobiologie, pathofysiologie en behandeling.
Pharmacol Ther 2011, 132:314.
85. Hashimoto K: Opkomende rol van glutamaat in de pathofysiologie van
ernstige depressieve stoornis. Brain Res Rev 2009, 61:105-123.
86. Hashimoto K, Sawa A, Iyo M: Verhoogde niveaus van glutamaat in de hersenen van
patiënten met stemmingsstoornissen. Biol Psychiatry 2007, 62:1310-1316.
87. Burbaeva G, Boksha IS, Turishcheva MS, Vorobyeva EA, Savushkina OK,
Tereshkina EB: glutaminesynthetase en glutamaatdehydrogenase in
de prefrontale cortex van patiënten met schizofrenie. Prog
Neuropsychopharmacol Biol Psychiatry 2003, 27:675.
88. Bhattacharyya S, Khanna S, Chakrabarty K, Mahadevan A, Christopher R,
Shankar SK: Anti-hersen-auto-antilichamen en veranderde prikkelende
neurotransmitters bij een obsessief-compulsieve stoornis.
Neuropsychofarmacologie 2009, 34:2489-2496.
89. Sanacora G, Gueorguieva R, Epperson CN, Wu YT, Appel M, Rothman DL,
Krystal JH, Mason GF: Subtype-specifieke veranderingen van gammaaminoboterzuur
zuur en glutamaat bij patiënten met ernstige depressie.
Arch Gen Psychiatry 2004, 61:705-713.
90. Marsman A, van den Heuvel MP, Klomp DW, Kahn RS, Luijten PR, Hulshoff
Pol HE: Glutamaat bij schizofrenie: een gerichte review en meta-analyse
van 1H-MRS-onderzoeken. Schizophr Bull 2013, 39:120-129.
91. Liu Y, Ho RC, Mak A: Interleukine (IL) -6, tumornecrosefactor alfa
(TNF-alfa) en oplosbare interleukine-2-receptoren (sIL-2R) zijn verhoogd in
patiënten met depressieve stoornis: een meta-analyse en metaregressie.
J Affectstoornis 2012, 139:230�239.
92. Brietzke E, Stabellini R, Grassis-Oliveira R, Lafer B: Cytokines in bipolaire
stoornis: recente bevindingen, schadelijke effecten maar belofte voor de toekomst
therapieën. CNS Spectr 2011. www.cnsspectrums.com/aspx/
artikeldetail.aspx?articleid=3596.
93. Denys D, Fluitman S, Kavelaars A, Heijnen C, Westenberg H: afgenomen
TNF-alfa- en NK-activiteit bij obsessief-compulsieve stoornis.
Psychoneuro-endocrinologie 2004, 29:945.
94. Brambilla F, Perna G, Bellodi L, Arancio C, Bertani A, Perini G, Carraro C, Gava
F: Plasma interleukine-1 bèta en tumornecrosefactorconcentraties in
obsessief-compulsieve stoornissen. Biol Psychiatry 1997, 42:976-981.
95. Fluitman S, Denys D, Vulink N, Schutters S, Heijnen C, Westenberg H:
Door lipopolysaccharide geïnduceerde cytokineproductie bij obsessief-compulsieve
stoornis en gegeneraliseerde sociale angststoornis. Psychiatrie
Res 2010, 178: 313-316.
96. Janelidze S, Mattei D, Westrin A, Traskman-Bendz L, Brundin L: Cytokine
niveaus in het bloed kunnen zelfmoordpogingen onderscheiden van depressieve
patiënten. Brain Behav Immun 2011, 25:335.
97. Postal M, Costallat LT, Appenzeller S: Neuropsychiatrische manifestaties bij
systemische lupus erythematosus: epidemiologie, pathofysiologie en
beheer. CNS Drugs 2011, 25:721.
98. Kozora E, Hanly JG, Lapteva L, Filley CM: cognitieve disfunctie bij
systemische lupus erythematosus: verleden, heden en toekomst.
Artritis Rheum 2008, 58:3286-3298.
99. Lancaster E, Martinez-Hernandez E, Dalmau J: encefalitis en antilichamen tegen
synaptische en neuronale celoppervlakte-eiwitten. Neurologie 2011, 77: 179.
100. Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon
R: Klinische ervaring en laboratoriumonderzoek bij patiënten met antiNMDAR
encefalitis. Lancet Neurol 2011, 10:63-74.
101. Lai M, Huijbers MG, Lancaster E, Graus F, Bataller L, Balice-Gordon R, Cowell
JK, Dalmau J: Onderzoek van LGI1 als het antigeen bij limbische encefalitis
eerder toegeschreven aan kaliumkanalen: een casusreeks. lancet neurol
2010, 9:776-785.
102. Lancaster E, Huijbers MG, Bar V, Boronat A, Wong A, Martinez-Hernandez E,
Wilson C, Jacobs D, Lai M, Walker RW, Graus F, Bataller L, Illa I, Markx S, Strauss
KA, Peles E, Scherer SS, Dalmau J: Onderzoeken van caspr2, een auto-antigeen van
encefalitis en neuromyotonie. Ann Neurol 2011, 69:303�311.
103. Lancaster E, Lai M, Peng X, Hughes E, Constantinescu R, Raizer J, Friedman
D, Skeen MB, Grisold W, Kimura A, Ohta K, Iizuka T, Guzman M, Graus F,
Moss SJ, Balice-Gordon R, Dalmau J: Antilichamen tegen de GABA(B)-receptor in
limbische encefalitis met toevallen: casusreeksen en karakterisering van de
antigeen. Lancet Neurol 2010, 9:67-76.
104. Lancaster E, Martinez-Hernandez E, Titulaer MJ, Boulos M, Weaver S, Antoine
JC, Liebers E, Kornblum C, Bien CG, Honnorat J, Wong S, Xu J, Aannemer A,
Balice-Gordon R, Dalmau J: Antilichamen tegen metabotrope glutamaat
receptor 5 in het Ophelia-syndroom. Neurologie 2011, 77:1698-1701.105. Ances BM, Vitaliani R, Taylor RA, Liebeskind DS, Voloschin A, Houghton DJ,
Galetta SL, Dichter M, Alavi A, Rosenfeld MR, Dalmau J: behandelingsresponsief
limbische encefalitis geïdentificeerd door neuropil-antilichamen: MRI en
PET correleert. Hersenen 2005, 128:1764-1777.
106. Tofaris GK, Irani SR, Cheeran BJ, Baker IW, Cader ZM, Vincent A:
Immunotherapie-responsieve chorea als het presenterende kenmerk van LGI1-
antilichaam encefalitis. Neurologie 2012, 79:195-196.
107. Najjar S, Pearlman D, Najjar A, Ghiasian V, Zagzag D, Devinsky O:
Extralimbische auto-immuun encefalitis geassocieerd met glutaminezuur
decarboxylase-antilichamen: een ondergediagnosticeerde entiteit? Epilepsie gedrag
2011, 21:306-313.
108. Titulaer MJ, McCracken L, Gabilondo I, Armangue T, Glaser C, Iizuka T, Honig
LS, Benseler SM, Kawachi I, Martinez-Hernandez E, Aguilar E, Gresa-Arribas N,
Ryan-Florance N, Torrents A, Saiz A, Rosenfeld MR, Balice-Gordon R, Graus F,
Dalmau J: behandeling en prognostische factoren voor langetermijnresultaten bij
patiënten met anti-NMDA-receptor-encefalitis: een observationeel cohort
studie. Lancet Neurol 2013, 12:157-165.
109. Dalmau J, Gleichman AJ, Hughes EG, Rossi JE, Peng X, Lai M, Dessain SK,
Rosenfeld MR, Balice-Gordon R, Lynch DR: anti-NMDA-receptor
encefalitis: casusreeksen en analyse van de effecten van antilichamen.
Lancet Neurol 2008, 7:1091-1098.
110. Graus F, Boronat A, Xifro X, Boix M, Svigelj V, Garcia A, Palomino A, Sabater
L, Alberch J, Saiz A: het groeiende klinische profiel van anti-AMPA-receptor
encefalitis. Neurologie 2010, 74:857-859.
111. Lai M, Hughes EG, Peng X, Zhou L, Gleichman AJ, Shu H, Mata S, Kremens
D, Vitaliani R, Geschwind MD, Bataller L, Kalb RG, Davis R, Graus F, Lynch DR,
Balice-Gordon R, Dalmau J: AMPA-receptorantilichamen in limbic
encefalitis verandert de locatie van de synaptische receptor. Ann Neurol 2009, 65:424.
112. Najjar S, Pearlman D, Devinsky O, Najjar A, Nadkarni S, Butler T, Zagzag D:
Neuropsychiatrische auto-immuun encefalitis met negatief VGKC-complex,
NMDAR- en GAD-auto-antilichamen: een casusrapport en literatuuronderzoek,
aanstaande. Cogn Behav Neurol. in de pers.
113. Najjar S, Pearlman D, Zagzag D, Devinsky O: Spontaan oplossen
seronegatieve auto-immuun limbische encefalitis. Cogn Gedrag Neurol 2011,
24: 99.
114. Gabilondo I, Saiz A, Galan L, Gonzalez V, Jadraque R, Sabater L, Sans A,
Sempere A, Vela A, Villalobos F, Vials M, Villoslada P, Graus F: analyse van
recidieven bij anti-NMDAR-encefalitis. Neurologie 2011, 77:996-999.
115. Barry H, Hardiman O, Healy DG, Keogan M, Moroney J, Molnar PP, Cotter
DR, Murphy KC: Anti-NMDA-receptor-encefalitis: een belangrijk
differentiële diagnose bij psychose. Br J Psychiatrie 2011, 199:508.
116. Dickerson F, Stallings C, Vaughan C, Origoni A, Khushalani S, Yolken R:
Antilichamen tegen de glutamaatreceptor bij manie. Bipolaire stoornis 2012,
14: 547.
117. O'Loughlin K, Ruge P, McCauley M: encefalitis en schizofrenie: een
kwestie van woorden. Br J Psychiatrie 2012, 201:74.
118. Parratt KL, Allan M, Lewis SJ, Dalmau J, Halmagyi GM, Spies JM: Acuut
psychiatrische ziekte bij een jonge vrouw: een ongebruikelijke vorm van encefalitis.
Med J Aust 2009, 191:284.
119. Suzuki Y, Kurita T, Sakurai K, Takeda Y, Koyama T: casusrapport van anti-NMDA
receptor encefalitis verdacht van schizofrenie. Seishin Shinkeigaku
Zasshi 2009, 111:1479-1484.
120. Tsutsui K, Kanbayashi T, Tanaka K, Boku S, Ito W, Tokunaga J, Mori A,
Hishikawa Y, Shimizu T, Nishino S: anti-NMDA-receptorantilichaam gedetecteerd
bij encefalitis, schizofrenie en narcolepsie met psychotische kenmerken.
BMC Psychiatrie 2012, 12:37.
121. Van Putten WK, Hachimi-Idrissi S, Jansen A, Van Gorp V, Huyghens L:
Soms voorkomende oorzaak van psychotisch gedrag bij een 9-jarig meisje: een geval
verslag doen van. Casusrapport Med 2012, 2012:358520.
122. Masdeu JC, Gonzalez-Pinto A, Matute C, Ruiz De Azua S, Palomino A, De
Leon J, Berman KF, Dalmau J: Serum IgG-antilichamen tegen de NR1
subeenheid van de NMDA-receptor niet gedetecteerd bij schizofrenie. ben J
Psychiatrie 2012, 169:1120.
123. Kirvan CA, Swedo SE, Kurahara D, Cunningham MW: Streptokokken mimicry
en antilichaam-gemedieerde celsignalering in de pathogenese van
chorea van Sydenham. Auto-immuniteit 2006, 39:21-29.
124. Swedo SE: Streptokokkeninfectie, Tourette-syndroom en OCS: is er
een connectie? Panda's: paard of zebra? Neurologie 2010, 74:1397-1398.
125. Morer A, Lazaro L, Sabater L, Massana J, Castro J, Graus F: antineuronaal
antistoffen in een groep kinderen met een obsessief-compulsieve stoornis
en Gilles de la Tourette. J Psychiatr Res 2008, 42:64-68.
126. Pavone P, Bianchini R, Parano E, Incorpora G, Rizzo R, Mazzone L, Trifiletti RR:
Anti-hersenantilichamen in PANDAS versus ongecompliceerde streptokokken
infectie. Pediatr Neurol 2004, 30:107-110.
127. Maina G, Albert U, Bogetto F, Borghese C, Berro AC, Mutani R, Rossi F,
Vigliani MC: Anti-hersenantilichamen bij volwassen patiënten met obsessief-compulsieve
wanorde. J Affect Disord 2009, 116:192-200.
128. Brimberg L, Benhar I, Mascaro-Blanco A, Alvarez K, Lotan D, Winter C, Klein J,
Moses AE, Somnier FE, Leckman JF, Swedo SE, Cunningham MW, Joel D:
Gedrags-, farmacologische en immunologische afwijkingen na
blootstelling aan streptokokken: een nieuw rattenmodel van Sydenham chorea en
verwante neuropsychiatrische aandoeningen. Neuropsychofarmacologie 2012,
37: 2076.
129. Dale RC, Candler PM, Kerk AJ, Wait R, Pocock JM, Giovannoni G:
Neuronale oppervlakte glycolytische enzymen zijn auto-antigeen doelwitten in
post-streptokokken auto-immuunziekte van het CZS. J Neuroimmunol 2006,
172: 187.
130. Nicholson TR, Ferdinando S, Krishnaiah RB, Anhoury S, Lennox BR, MataixCols
D, Cleare A, Veale DM, Drummond LM, Fineberg NA, Kerk AJ,
Giovannoni G, Heyman I: Prevalentie van anti-basale ganglia-antilichamen in
obsessief-compulsieve stoornis bij volwassenen: transversaal onderzoek. Br J Psychiatrie
2012, 200:381-386.
131. Wu K, Hanna GL, Rosenberg DR, Arnold PD: de rol van glutamaat
signalering in de pathogenese en behandeling van obsessief-compulsieve
wanorde. Pharmacol Biochem Behav 2012, 100:726.
132. Perlmutter SJ, Leitman SF, Garvey MA, Hamburger S, Feldman E, Leonard
HL, Swedo SE: therapeutische plasma-uitwisseling en intraveneus
immunoglobuline voor obsessief-compulsieve stoornis en ticstoornissen bij
jeugd. Lancet 1999, 354:1153-1158.
133. Pereira A Jr, Furlan FA: Astrocyten en menselijke cognitie: modellering
informatie-integratie en modulatie van neuronale activiteit.
Prog Neurobiol 2010, 92:405-420.
134. Barres BA: Het mysterie en de magie van glia: een perspectief op hun rollen in
gezondheid en ziekte. Neuron 2008, 60:430-440.
135. Verkhratsky A, Parpura V, Rodriguez JJ: Waar de gedachten wonen: de
fysiologie van neuronaal-gliaal "diffuus neuraal net". Hersenonderzoek Rev 2011,
66: 133.
136. Sofroniew MV: Moleculaire dissectie van reactieve astrogliose en gliaal litteken
vorming. Trends Neurosci 2009, 32:638.
137. Hamilton NB, Attwell D: Exocytose astrocyten echt neurotransmitters?
Nat Rev Neurosci 2010, 11:227-238.
138. Rajkowska G: Postmortaal onderzoek naar stemmingsstoornissen wijst op veranderde
aantal neuronen en gliacellen. Biol Psychiatry 2000, 48:766.
139. Coupland NJ, Ogilvie CJ, Hegadoren KM, Seres P, Hanstock CC, Allen PS:
Verminderde prefrontale Myo-inositol bij depressieve stoornis.
Biol Psychiatry 2005, 57:1526.
140. Miguel-Hidalgo JJ, Overholser JC, Jurjus GJ, Meltzer HY, Dieter L, Konick L,
Stockmeier CA, Rajkowska G: Vasculaire en extravasculaire immunoreactiviteit
voor intercellulair adhesiemolecuul 1 in de orbitofrontale cortex van
proefpersonen met ernstige depressie: leeftijdsafhankelijke veranderingen. J Stoornis beïnvloeden
2011, 132:422-431.
141. Miguel-Hidalgo JJ, Wei JR, Andrew M, Overholser JC, Jurjus G, Stockmeier
CA, Rajkowska G: Glia-pathologie in de prefrontale cortex bij alcohol
afhankelijkheid met en zonder depressieve symptomen. Biol Psychiatrie 2002,
52: 1121.
142. Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, Meltzer HY,
Uylings HB, Friedman L, Rajkowska G: Cellulaire veranderingen in de postmortale
hippocampus bij ernstige depressie. Biol Psychiatry 2004, 56:640-650.
143. Ong�r D, Drevets WC, Prijs JL: Gliale reductie in het subgenuale prefrontale
cortex bij stemmingsstoornissen. Proc Natl Acad Sci USA 1998, 95:13290-13295.
144. Gittins RA, Harrison PJ: een morfometrische studie van glia en neuronen in de
anterieure cingulate cortex bij stemmingsstoornis. J Affectstoornis 2011,
133: 328.
145. Cotter D, Mackay D, Beasley C, Kerwin R, Everall I: verminderde gliale dichtheid
en neuronaal volume bij depressieve stoornis en schizofrenie bij
de anterieure cingulate cortex [abstract]. Schizofrenie Onderzoek 2000, 41:106.
146. Si X, Miguel-Hidalgo JJ, Rajkowska G: GFAP-expressie is verminderd in de
dorsolaterale prefrontale cortex bij depressie. In de Vereniging voor Neurowetenschappen; 2003.
Neurowetenschap Meeting Planne: New Orleans; 2003.
147. Legutko B, Mahajan G, Stockmeier CA, Rajkowska G: Astrocyten van de witte stof
zijn verminderd bij depressie. In de Vereniging voor Neurowetenschappen. Neurowetenschappelijke bijeenkomst
Planner: Washington, DC; 2011.148. Edgar N, Sibille E: een vermeende functionele rol voor oligodendrocyten in
stemming regulatie. Vertaal Psychiatrie 2012, 2:e109.
149. Rajkowska G, Halaris A, Selemon LD: verminderingen in neuronale en gliale
dichtheid karakteriseren de dorsolaterale prefrontale cortex in bipolaire
wanorde. Biol Psychiatry 2001, 49:741.
150. Cotter D, Mackay D, Chana G, Beasley C, Landau S, Everall IP: verlaagd
neuronale grootte en gliale celdichtheid in gebied 9 van de dorsolaterale
prefrontale cortex bij personen met een depressieve stoornis. Cereb Cortex
2002, 12:386-394.
151. Stark AK, Uylings HB, Sanz-Arigita E, Pakkenberg B: verlies van gliacellen in de
anterior cingulate cortex, een subregio van de prefrontale cortex, in
proefpersonen met schizofrenie. Am J Psychiatry 2004, 161: 882-888.
152. Konopaske GT, Dorph-Petersen KA, Sweet RA, Pierri JN, Zhang W, Sampson
AR, Lewis DA: Effect van chronische blootstelling aan antipsychotica op astrocyten en
aantal oligodendrocyten bij makaken. Biol Psychiatrie 2008,
63: 759.
153. Selemon LD, Lidow MS, Goldman-Rakic PS: verhoogd volume en glia
dichtheid in prefrontale cortex van primaten geassocieerd met chronische
blootstelling aan antipsychotica. Biol Psychiatry 1999, 46:161-172.
154. Steiner J, Bernstein HG, Bielau H, Farkas N, Winter J, Dobrowolny H, Brisch R,
Gos T, Mawrin C, Myint AM, Bogerts B: S100B-immunopositieve glia is
verhoogd in paranoïde in vergelijking met resterende schizofrenie: a
morfometrische studie. J Psychiatr Res 2008, 42:868-876.
155. Carter CJ: eIF2B en overleving van oligodendrocyten: waar natuur en opvoeding
ontmoeten bij bipolaire stoornis en schizofrenie? Schizofre stier 2007,
33: 1343.
156. Hayashi Y, Nihonmatsu-Kikuchi N, Hisanaga S, Yu XJ, Tatebayashi Y:
Neuropathologische overeenkomsten en verschillen tussen schizofrenie
en bipolaire stoornis: een flowcytometrische postmortale hersenstudie.
PLoS One 2012, 7:e33019.
157. Uranova NA, Vikhreva OV, Rachmanova VI, Orlovskaya DD: Ultrastructureel
veranderingen van gemyeliniseerde vezels en oligodendrocyten in de prefrontale
cortex bij schizofrenie: een postmortem morfometrische studie.
Schizophr Res-behandeling 2011, 2011:325789.
158. Torres-Platas SG, Hercher C, Davoli MA, Maussion G, Labonte B, Turecki
G, Mechawar N: Astrocytische hypertrofie in anterieure cingulate wit
kwestie van depressieve zelfmoorden. Neuropsychofarmacologie 2011,
36: 2650.
159. Pereira A Jr, Furlan FA: over de rol van synchronie voor neuron-astrocyten
interacties en perceptuele bewuste verwerking. J Biol Phys 2009,
35: 465.
160. Kettenmann H, Hanisch UK, Noda M, Verkhratsky A: Fysiologie van
microglia. Physiol Rev 2011, 91:461.
161. Tremblay ME, Stevens B, Sierra A, Wake H, Bessis A, Nimmerjahn A: De rol
van microglia in de gezonde hersenen. J Neurosci 2011, 31:16064-16069.
162. Kaindl AM, Degos V, Peineau S, Gouadon E, Chhor V, Loron G, Le
Charpentier T, Josserand J, Ali C, Vivien D, Collingridge GL, Lombet A, Issa L,
Rene F, Loeffler JP, Kavelaars A, Verney C, Mantz J, Gressens P: Activering van
microgliale N-methyl-D-aspartaatreceptoren veroorzaken ontstekingen en
neuronale celdood in de zich ontwikkelende en volwassen hersenen. Ann Neurol
2012, 72:536-549.
163. Schwartz M, Shaked I, Fisher J, Mizrahi T, Schori H: Beschermend
auto-immuniteit tegen de vijand binnen: het bestrijden van glutamaattoxiciteit.
Trends Neurosci 2003, 26:297/302.
164. Pacheco R, Gallart T, Lluis C, Franco R: rol van glutamaat op T-cel
gemedieerde immuniteit. J Neuroimmunol 2007, 185:9-19.
165. Najjar S, Pearlman D, Miller DC, Devinsky O: Refractaire epilepsie geassocieerd
met microgliale activatie. Neuroloog 2011, 17:249-254.
166. Schwartz M, Butovsky O, Bruck W, Hanisch UK: Microgliaal fenotype: is de
verbintenis omkeerbaar? Trends Neurosci 2006, 29:68-74.
167. Wang F, Wu H, Xu S, Guo X, Yang J, Shen X: Macrofaagmigratie
remmende factor activeert cyclo-oxygenase 2-prostaglandine E2 in gekweekte
spinale microglia. Neurosci Res 2011, 71:210-218.
168. Zhang XY, Xiu MH, Lied C, Chenda C, Wu GY, Haile CN, Kosten TA, Kosten
TR: Verhoogd serum S100B in nooit-medicinale en medicinale
schizofrene patiënten. J Psychiatr Res 2010, 44:1236.
169. Kawasaki Y, Zhang L, Cheng JK, Ji RR: Cytokinemechanismen van centraal
sensibilisatie: duidelijke en overlappende rol van interleukine-1beta,
interleukine-6 en tumornecrosefactor-alfa bij het reguleren van synaptische en
neuronale activiteit in het oppervlakkige ruggenmerg. J Neurosci 2008,
28: 5189.
170. Müller N, Schwarz MJ: De immunologische basis van glutamaterge
stoornis bij schizofrenie: naar een integrale blik. J neuraal
Transm Suppl 2007, 72:269-280.
171. Hestad KA, Tonseth S, Stoen CD, Ueland T, Aukrust P: verhoogde plasmaspiegels
van tumornecrosefactor-alfa bij patiënten met depressie: normalisatie
tijdens elektroconvulsietherapie. J ECT 2003, 19:183.
172. Kubera M, Kenis G, Bosmans E, Zieba A, Dudek D, Nowak G, Maes M:
Plasmaspiegels van interleukine-6, interleukine-10 en interleukine-1-receptor
antagonist bij depressie: vergelijking tussen de acute toestand en na
kwijtschelding. Pol J Pharmacol 2000, 52:237.
173. Miller BJ, Buckley P, Seabolt W, Mellor A, Kirkpatrick B: meta-analyse van
cytokineveranderingen bij schizofrenie: klinische status en antipsychoticum
Effecten. Biol Psychiatry 2011, 70:663.
174. Potvin S, Stip E, Sepehry AA, Gendron A, Bah R, Kouassi E: Inflammatoir
cytokine-veranderingen bij schizofrenie: een systematische kwantitatieve review.
Biol Psychiatry 2008, 63:801.
175. Reale M, Patruno A, De Lutiis MA, Pesce M, Felaco M, Di Giannantonio M, Di
Nicola M, Grilli A: Ontregeling van de productie van chemo-cytokine in
schizofrene patiënten versus gezonde controles. BMC Neurosci 2011, 12:13.
176. Fluitman SB, Denys DA, Heijnen CJ, Westenberg HG: Walging treft TNFalpha,
IL-6- en noradrenalinespiegels bij patiënten met obsessief-compulsieve
wanorde. Psychoneuro-endocrinologie 2010, 35:906-911.
177. Konuk N, Tekin IO, Ozturk U, Atik L, Atasoy N, Bektas S, Erdogan A: Plasma
niveaus van tumornecrosefactor-alfa en interleukine-6 bij obsessieve
dwangstoornis. Bemiddelaars Inflamm 2007, 2007:65704.
178. Monteleone P, Catapano F, Fabrazzo M, Tortorella A, Maj M: afgenomen
bloedspiegels van tumornecrosefactor-alfa bij patiënten met obsessief-compulsieve
wanorde. Neuropsychobiologie 1998, 37: 182-185.
179. Marazziti D, Presta S, Pfanner C, Gemignani A, Rossi A, Sbrana S, Rocchi V,
Ambrogi F, Cassano GB: immunologische veranderingen bij obsessief-compulsieve volwassenen
wanorde. Biol Psychiatry 1999, 46:810.
180. Zai G, Arnold PD, Burroughs E, Richter MA, Kennedy JL: tumornecrose
factor-alfa-gen is niet geassocieerd met een obsessief-compulsieve stoornis.
Psychiater Genet 2006, 16:43.
181. Rodríguez AD, Gonz�lez PA, Garc�a MJ, de la Rosa A, Vargas M, Marrero F:
Circadiane variaties in pro-inflammatoire cytokineconcentraties bij acute
myocardinfarct. Rev Esp Cardiol 2003, 56:555-560.
182. Oliver JC, Bland LA, Oettinger CW, Arduino MJ, McAllister SK, Agüero SM,
Favero MS: Cytokinekinetiek in een in vitro volbloedmodel volgens:
een endotoxine-uitdaging. Lymfokine Cytokine Res 1993, 12: 115-120.
183. Le T, Leung L, Carroll WL, Schibler KR: regulering van het interleukine-10-gen
expressie: mogelijke mechanismen die verantwoordelijk zijn voor de opregulatie en voor
rijpingsverschillen in de expressie ervan door mononucleaire bloedcellen.
Bloed 1997, 89:4112-4119.
184. Lee MC, Ting KK, Adams S, Brew BJ, Chung R, Guillemin GJ:
Karakterisering van de expressie van NMDA-receptoren bij de mens
astrocyten. PLoS One 2010, 5:e14123.
185. Myint AM, Kim YK, Verkerk R, Scharpe S, Steinbusch H, Leonard B:
Kynurenine-route bij ernstige depressie: bewijs van verminderde
neurobescherming. J Affect Disord 2007, 98: 143.
186. Sanacora G, Treccani G, Popoli M: Op weg naar een glutamaathypothese van
depressie: een opkomende grens van neuropsychofarmacologie voor
stemmingsstoornissen. Neurofarmacologie 2012, 62:63-77.
187. Saleh A, Schroeter M, Jonkmanns C, Hartung HP, Modder U, Jander S: In
vivo MRI van hersenontsteking bij ischemische beroerte bij de mens. Hersenen 2004,
127: 1670.
188. Tilleux S, Hermans E: Neuro-ontsteking en regulatie van gliale glutamaat
opname bij neurologische aandoeningen. J Neurosci Res 2007, 85:2059-2070.
189. Helms HC, Madelung R, Waagepetersen HS, Nielsen CU, Brodin B: in vitro
bewijs voor de hersenglutamaat-effluxhypothese: hersenendotheel
cellen samengekweekt met astrocyten vertonen een gepolariseerd brein-naar-bloed
transport van glutamaat. 2012, 60:882.
190. Leonard BE: Het concept van depressie als een disfunctie van het immuunsysteem
systeem. Curr Immunol Rev 2010, 6:205-212.
191. Labrie V, Wong AH, Roder JC: bijdragen van de D-serine-route aan
schizofrenie. Neurofarmacologie 2012, 62:1484-1503.
192. Gras G, Samah B, Hubert A, Leone C, Porcheray F, Rimaniol AC: EAAT
expressie door macrofagen en microglia: nog meer vragen dan
antwoorden. Aminozuren 2012, 42:221-229.
193. Livingstone PD, Dickinson JA, Srinivasan J, Kew JN, Wonnacott S:
Glutamaat-dopamine overspraak in de prefrontale cortex van de rat wordt gemoduleerd door Alpha7 nicotinereceptoren en versterkt door PNU-120596. J Mol
Neurosci 2010, 40:172-176.194. Kondziella D, Brenner E, Eyjolfsson EM, Sonnewald U: Hoe glialneuronal
interacties passen in de huidige neurotransmitterhypothesen van
schizofrenie? Neurochem Int 2007, 50:291-301.
195. Wu HQ, Pereira EF, Bruno JP, Pellicciari R, Albuquerque EX, Schwarcz R: De
van astrocyten afgeleide alfa7 nicotinereceptorantagonist kynureenzuur
regelt de extracellulaire glutamaatniveaus in de prefrontale cortex. J Mol
Neurosci 2010, 40:204-210.
196. Steiner J, Bogerts B, Schroeter ML, Bernstein HG: S100B-eiwit in
neurodegeneratieve aandoeningen. Clin Chem Lab Med 2011, 49:409.
197. Steiner J, Marquardt N, Pauls I, Schiltz K, Rahmoune H, Bahn S, Bogerts B,
Schmidt RE, Jacobs R: Menselijke CD8(+) T-cellen en NK-cellen brengen en
scheiden S100B af bij stimulatie. Brain Behav Immun 2011, 25:1233-1241.
198. Shanmugam N, Kim YS, Lanting L, Natarajan R: Regulering van
cyclo-oxygenase-2-expressie in monocyten door ligatie van de receptor
voor geavanceerde glycatie eindproducten. J Biol Chem 2003, 278:34834-34844.
199. Rothermundt M, Ohrmann P, Abel S, Siegmund A, Pedersen A, Ponath G,
Suslow T, Peters M, Kaestner F, Heindel W, Arolt V, Pfleiderer B: gliacel
activering in een subgroep van patiënten met schizofrenie aangegeven door
verhoogde S100B-serumconcentraties en verhoogde myo-inositol.
Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:361.
200. Falcone T, Fazio V, Lee C, Simon B, Franco K, Marchi N, Janigro D: Serum
S100B: een potentiële biomarker voor suïcidaliteit bij adolescenten? PLoS One
2010, 5:e11089.
201. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Serum
markers ondersteunen ziektespecifieke gliale pathologie bij ernstige depressie.
J Affectstoornis 2008, 111:271�280.
202. Rothermundt M, Ahn JN, Jorgens S: S100B bij schizofrenie: een update.
Gen Physiol Biophys 2009, 28 Spec. nr. Focus: F76-F81.
203. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: neuronspecifiek
enolase is ongewijzigd, terwijl S100B verhoogd is in serum van
patiënten met schizofrenie origineel onderzoek en meta-analyse.
Psychiatrie Res 2009, 167:66-72.
204. Rothermundt M, Missler U, Arolt V, Peters M, Leadbeater J, Wiesmann M,
Rudolf S, Wandinger KP, Kirchner H: verhoogde S100B-bloedspiegels in
niet-medicamenteuze en behandelde schizofrene patiënten zijn gecorreleerd met
negatieve symptomatologie. Mol Psychiatrie 2001, 6:445.
205. Suchankova P, Klang J, Cavanna C, Holm G, Nilsson S, Jonsson EG, Ekman A:
Is het Gly82Ser-polymorfisme in het RAGE-gen relevant voor?
schizofrenie en het persoonlijkheidskenmerk psychoticisme? J Psychiatrie Neurowetenschappen
2012, 37:122-128.
206. Scapagnini G, Davinelli S, Drago F, De Lorenzo A, Oriani G: antioxidanten als
antidepressiva: feit of fictie? CNS Drugs 2012, 26:477.
207. Ng F, Berk M, Dean O, Bush AI: oxidatieve stress bij psychiatrische stoornissen:
bewijsbasis en therapeutische implicaties. Int J Neuropsychopharmacol
2008, 11:851-876.
208. Salim S, Chugh G, Asghar M: Ontsteking bij angst. Adv Protein Chem
Structuur Biol 2012, 88:1�25.
209. Anderson G, Berk M, Dodd S, Bechter K, Altamura AC, Dell'osso B, Kanba S,
Monji A, Fatemi SH, Buckley P, Debnath M, Das UN, Meyer U, Müller N,
Kanchanatawan B, Maes M: Immuno-inflammatoire, oxidatieve en nitrosatieve
stress en neuroprogressieve paden in de etiologie, het verloop en de behandeling
van schizofrenie. Prog Neuropsychopharmacol Biol Psychiatry 2013, 42:1�42.
210. Coughlin JM, Ishizuka K, Kano SI, Edwards JA, Seifuddin FT, Shimano MA,
Daley EL, et al: Duidelijke vermindering van oplosbaar superoxide dismutase-1
(SOD1) in cerebrospinale vloeistof van patiënten met recent ontstane
schizofrenie. Mol Psychiatrie 2012, 18:10-11.
211. Bombaci M, Grifantini R, Mora M, Reguzzi V, Petracca R, Meoni E, Balloni S,
Zingaretti C, Falugi F, Manetti AG, Margarit I, Musser JM, Cardona F, Orefici
G, Grandi G, Bensi G: Proteïnearray-profilering van tic-patiëntensera onthult a
breed bereik en verbeterde immuunrespons tegen Groep A
Streptococcus-antigenen. PLoS One 2009, 4:e6332.
212. Valerio A, Cardile A, Cozzi V, Bracale R, Tedesco L, Pisconti A, Palomba L,
Cantoni O, Clementi E, Moncada S, Carruba MO, Nisoli E: TNF-alfa
downreguleert eNOS-expressie en mitochondriale biogenese in vet
en spieren van zwaarlijvige knaagdieren. J Clin Invest 2006, 116:2791-2798.
213. Ott M, Gogvadze V, Orrenius S, Zhivotovsky B: mitochondriën, oxidatief
stress en celdood. Apoptose 2007, 12:913.
214. Shalev H, Serlin Y, Friedman A: Doorbreken van de bloed-hersenbarrière als poort
tot psychiatrische stoornis. Cardiovasc Psychiatry Neurol 2009, 2009:278531.
215. Abbott NJ, Ronnback L, Hansson E: Astrocyt-endotheliale interacties aan de
bloed-hersen barrière. Nat Rev Neurosci 2006, 7:41-53.
216. Bechter K, Reiber H, Herzog S, Fuchs D, Tumani H, Maxeiner HG:
Analyse van hersenvocht in affectieve en schizofreen spectrum
aandoeningen: identificatie van subgroepen met immuunresponsen en
disfunctie van de bloed-CSF-barrière. J Psychiatr Res 2010, 44:321-330.
217. Harris LW, Wayland M, Lan M, Ryan M, Giger T, Lockstone H, Wuethrich I,
Mimmack M, Wang L, Kotter M, Craddock R, Bahn S: De cerebrale
microvasculatuur bij schizofrenie: een onderzoek naar microdissectie met laseropname.
PLoS One 2008, 3:e3964.
218. Lin JJ, Mula M, Hermann BP: het neurologische gedrag blootleggen
comorbiditeiten van epilepsie gedurende de levensduur. Lancet 2012, 380: 1180 1192.
219. Isingrini E, Belzung C, Freslon JL, Machet MC, Camus V: Fluoxetine-effect op
aorta stikstofmonoxide-afhankelijke vasorelaxatie in het onvoorspelbare
chronisch mild stressmodel van depressie bij muizen. Psychosom Med 2012,
74: 63.
220. Zhang XY, Zhou DF, Cao LY, Zhang PY, Wu GY, Shen YC: Het effect van
risperidon behandeling op superoxide dismutase bij schizofrenie. J Clin
Psychopharmacol 2003, 23: 128-131.
221. Lavoie KL, Pelletier R, Arsenault A, Dupuis J, Bacon SL: associatie tussen
klinische depressie en endotheelfunctie gemeten door onderarm
hyperemische reactiviteit. Psychosom Med 2010, 72:20-26.
222. Chrapko W, Jurasz P, Radomski MW, Archer SL, Newman SC, Baker G, Lara N,
Le Melledo JM: Verandering van verlaagde plasma NO-metabolieten en
bloedplaatjes NO-synthase-activiteit door paroxetine bij depressieve patiënten.
Neuropsychofarmacologie 2006, 31:1286-1293.
223. Chrapko WE, Jurasz P, Radomski MW, Lara N, Archer SL, Le Melledo JM:
Verminderde activiteit van stikstofmonoxidesynthase van bloedplaatjes en plasmastikstofmonoxide
metabolieten bij depressieve stoornissen. Biol Psychiatry 2004, 56:129-134.
224. Stuehr DJ, Santolini J, Wang ZQ, Wei CC, Adak S: update over het mechanisme
en katalytische regulatie in de NO-synthasen. J Biol Chem 2004,
279: 36167.
225. Chen W, Druhan LJ, Chen CA, Hemann C, Chen YR, Berka V, Tsai AL, Zweier
JL: Peroxynitriet induceert vernietiging van de tetrahydrobiopterine en
heem in endotheliaal stikstofmonoxidesynthase: overgang van reversibel naar
onomkeerbare enzymremming. Biochemie 2010, 49:3129-3137.
226. Chen CA, Wang TY, Varadharaj S, Reyes LA, Hemann C, Talukder MA, Chen
YR, Druhan LJ, Zweier JL: S-glutathionylering ontkoppelt eNOS en
regelt zijn cellulaire en vasculaire functie. Natuur 2010, 468:1115�1118.
227. Szabo C, Ischiropoulos H, Radi R: Peroxynitriet: biochemie,
pathofysiologie en ontwikkeling van therapieën. Nat Rev Drug Discov
2007, 6:662-680.
228. Papakostas GI, Shelton RC, Zajecka JM, Etemad B, Rickels K, Clain A, Baer L,
Dalton ED, Sacco GR, Schoenfeld D, Pencina M, Meisner A, Bottiglieri T,
Nelson E, Mischoulon D, Alpert JE, Barbee JG, Zisook S, Fava M: Lmethylfolaat
als aanvullende therapie voor SSRI-resistente majeure depressie:
resultaten van twee gerandomiseerde, dubbelblinde, parallel-sequentiële onderzoeken. ben J
Psychiatrie 2012, 169:1267.
229. Antoniades C, Shirodaria C, Warrick N, Cai S, de Bono J, Lee J, Leeson P,
Neubauer S, Ratnatunga C, Pillai R, Refsum H, Channon KM: 5-
methyltetrahydrofolaat verbetert snel de endotheelfunctie en
vermindert de productie van superoxide in menselijke bloedvaten: effecten op vasculaire
beschikbaarheid van tetrahydrobiopterine en endotheliaal stikstofmonoxidesynthase
koppelen. Oplage 2006, 114:1193-1201.
230. Masano T, Kawashima S, Toh R, Satomi-Kobayashi S, Shinohara M, Takaya T,
Sasaki N, Takeda M, Tawa H, Yamashita T, Yokoyama M, Hirata K: gunstig
effecten van exogeen tetrahydrobiopterine op de remodellering van de linkerventrikel
na myocardinfarct bij ratten: de mogelijke rol van oxidatieve stress
veroorzaakt door ontkoppeld endotheliaal stikstofmonoxidesynthase. Circa J 2008,
72: 1512.
231. Alp NJ, Channon KM: Regulatie van endotheliaal stikstofoxidesynthase door
tetrahydrobiopterine bij vaatziekten. Arterioscler Tromb Vasc Biol 2004,
24: 413.
232. Szymanski S, Ashtari M, Zito J, Degreef G, Bogerts B, Lieberman J:
Gadolinium-DTPA verbeterde gradiënt echo magnetische resonantie scans in
eerste episode van psychose en chronische schizofrene patiënten.
Psychiatrie Res 1991, 40:203-207.
233. Butler T, Weisholtz D, Isenberg N, Harding E, Epstein J, Stern E, Silbersweig
D: Neuroimaging van frontaal-limbische disfunctie bij schizofrenie en
epilepsie-gerelateerde psychose: naar een convergente neurobiologie.
Epilepsiegedrag 2012, 23:113-122.234. Butler T, Maoz A, Vallabhajosula S, Moeller J, Ichise M, Paresh K, Pervez F,
Friedman D, Goldsmith S, Najjar S, Osborne J, Solnes L, Wang X, Frans J,
Thesen T, Devinsky O, Kuzniecky R, Stern E, Silbersweig D: beeldvorming
ontsteking bij een patiënt met epilepsie geassocieerd met antilichamen tegen
glutaminezuurdecarboxylase [abstract]. In Am Epilepsy Society Abstracts,
Deel 2. Baltimore: American Epilepsy Society; 2011:191.
235. van Berckel BN, Bossong MG, Boellaard R, Kloet R, Schuitemaker A, Caspers
E, Luurtsema G, Windhorst AD, Cahn W, Lammertsma AA, Kahn RS:
Microglia-activering bij recent ontstane schizofrenie: een kwantitatieve (R)-
[11C]PK11195 positron emissie tomografie studie. Biol Psychiatrie 2008,
64: 820.
236. Doorduin J, de Vries EF, Willemsen AT, de Groot JC, Dierckx RA, Klein HC:
Neuro-ontsteking bij schizofrenie-gerelateerde psychose: een PET-onderzoek.
J Nucl Med 2009, 50:1801-1807.
237. Takano A, Arakawa R, Ito H, Tateno A, Takahashi H, Matsumoto R, Okubo Y,
Suhara T: Perifere benzodiazepinereceptoren bij patiënten met chronische
schizofrenie: een PET-onderzoek met [11C]DAA1106. Int J
Neuropsychopharmacol 2010, 13:943.
238. Müller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Muller B,
Spellmann I, Hetzel G, Maino K, Kleindienst N, Müller HJ, Arolt V, Riedel M:
De cyclo-oxygenase-2-remmer celecoxib heeft therapeutische effecten bij
ernstige depressie: resultaten van een dubbelblinde, gerandomiseerde placebo
gecontroleerde, aanvullende pilotstudie voor reboxetine. Mol Psychiatrie 2006,
11: 680.
239. Akhondzadeh S, Jafari S, Raisi F, Nasehi AA, Ghoreishi A, Salehi B, MohebbiRasa
S, Raznahan M, Kamalipour A: Klinische proef van adjuvante celecoxib
behandeling bij patiënten met ernstige depressie: een dubbelblinde en
placebo-gecontroleerd onderzoek. Depressieve angst 2009, 26:607.
240. Mendlewicz J, Kriwin P, Oswald P, Souery D, Alboni S, Brunello N:
Verkorte aanvang van de werking van antidepressiva bij ernstige depressie met behulp van
acetylsalicylzuur-augmentatie: een pilot-open-labelonderzoek. Int Clin
Psychopharmacol 2006, 21: 227-231.
241. Uher R, Carver S, Power RA, Mors O, Maier W, Rietschel M, Hauser J,
Dernovsek MZ, Henigsberg N, Souery D, Placentino A, boer A, McGuffin P:
Niet-steroïde anti-inflammatoire geneesmiddelen en werkzaamheid van antidepressiva bij
ernstige depressieve stoornis. Psychol Med 2012, 42:2027-2035.
242. Müller N, Riedel M, Scheppach C, Brandstatter B, Sokullu S, Krampe K,
Ulmschneider M, Engel RR, Moller HJ, Schwarz MJ: gunstig antipsychoticum
effecten van aanvullende therapie met celecoxib in vergelijking met alleen risperidon bij
schizofrenie. Am J Psychiatry 2002, 159:1029-1034.
243. Müller N, Riedel M, Schwarz MJ, Engel RR: Klinische effecten van COX-2
remmers op cognitie bij schizofrenie. Eur Arch Psychiatrie Clin Neurosci
2005, 255:149-151.
244. Müller N, Krause D, Dehning S, Musil R, Schennach-Wolff R, Obermeier M,
Moller HJ, Klauss V, Schwarz MJ, Riedel M: behandeling met celecoxib in een vroeg stadium
stadium van schizofrenie: resultaten van een gerandomiseerde, dubbelblinde, placebogecontroleerde
proef van celecoxib augmentatie van amisulpride behandeling.
Schizophr Res 2010, 121: 118-124.
245. Sayyah M, Boostani H, Pakseresht S, Malayeri A: een voorlopige gerandomiseerde
dubbelblind klinisch onderzoek naar de werkzaamheid van celecoxib als adjuvans bij
de behandeling van een obsessief-compulsieve stoornis. Psychiatrie Onderzoek 2011,
189: 403.
246. Sublette ME, Ellis SP, Geant AL, Mann JJ: meta-analyse van de effecten van
eicosapentaeenzuur (EPA) in klinische onderzoeken bij depressie. J Clin
Psychiatrie 2011, 72:1577.
247. Bloch MH, Hannestad J: Omega-3-vetzuren voor de behandeling van
depressie: systematische review en meta-analyse. Mol Psychiatrie 2012,
17: 1272.
248. Keller WR, Kum LM, Wehring HJ, Koola MM, Buchanan RW, Kelly DL: A
beoordeling van ontstekingsremmende middelen voor symptomen van schizofrenie.
J Psychopharmacol.
249. Warner-Schmidt JL, Vanover KE, Chen EY, Marshall JJ, Greengard P:
Antidepressieve effecten van selectieve serotonineheropnameremmers (SSRI's)
worden verzwakt door anti-inflammatoire geneesmiddelen bij muizen en mensen. Proc Natl
Acad Sci VS 2011, 108:9262-9267.
250. Gallagher PJ, Castro V, Fava M, Weilburg JB, Murphy SN, Gainer VS, Churchill
SE, Kohane IS, Iosifescu DV, Smoller JW, Perlis RH: reactie op antidepressiva
bij patiënten met ernstige depressie die zijn blootgesteld aan NSAID's: a
onderzoek naar geneesmiddelenbewaking. Am J Psychiatry 2012, 169:1065-1072.
251. Shelton RC: Vermindert gelijktijdig gebruik van NSAID's de effectiviteit van?
antidepressiva? Am J Psychiatry 2012, 169:1012-1015.
252. Martinez-Gras I, Perez-Nievas BG, Garcia-Bueno B, Madrigal JL, AndresEsteban
E, Rodriguez-Jimenez R, Hoenicka J, Palomo T, Rubio G, Leza JC:
De ontstekingsremmende prostaglandine 15d-PGJ2 en zijn nucleaire receptor
PPARgamma zijn verlaagd bij schizofrenie. Schizofret onderzoek 2011,
128: 15.
253. Garcia-Bueno B, Perez-Nievas BG, Leza JC: Is er een rol voor de nucleaire
receptor PPARgamma bij neuropsychiatrische ziekten? Int J
Neuropsychopharmacol 2010, 13:1411.
254. Meyer U: Ontstekingsremmende signalering bij schizofrenie. Hersengedrag
Immun 2011, 25:1507-1518.
255. Ramer R, Heinemann K, Merkord J, Rohde H, Salamon A, Linnebacher M,
Hinz B: COX-2 en PPAR-gamma verlenen door cannabidiol geïnduceerde apoptose
van menselijke longkankercellen. Mol Kanker Ther 2013, 12:69-82.
256. Henry CJ, Huang Y, Wynne A, Hanke M, Himler J, Bailey MT, Sheridan JF,
Godbout JP: Minocycline verzwakt door lipopolysaccharide (LPS) geïnduceerd
neuro-inflammatie, ziektegedrag en anhedonie.
J Neuro-ontsteking 2008, 5:15.
257. Sarris J, Mischoulon D, Schweitzer I: Omega-3 voor bipolaire stoornis: meta-analyses
van gebruik bij manie en bipolaire depressie. J Clin Psychiatrie 2012,
73: 81.
258. Amminger GP, Schafer MR, Papageorgiou K, Klier CM, Cotton SM, Harrigan
SM, Mackinnon A, McGorry PD, Berger GE: Lange-keten omega-3 vetzuren
voor geïndiceerde preventie van psychotische stoornissen: een gerandomiseerde, placebogecontroleerde
proces. Arch Gen Psychiatry 2010, 67:146-154.
259. Fusar-Poli P, Berger G: Eicosapentaeenzuurinterventies in
schizofrenie: meta-analyse van gerandomiseerde, placebo-gecontroleerde onderzoeken.
J Clin Psychopharmacol 2012, 32: 179-185.
260. Zorumski CF, Paul SM, Izumi Y, Covey DF, Mennerick S: Neurosteroïden,
stress en depressie: potentiële therapeutische mogelijkheden.
Neurosci Biobehav Rev 2013, 37:109-122.
261. Uhde TW, Singareddy R: biologisch onderzoek naar angststoornissen. In
Psychiatrie als neurowetenschap. Bewerkt door Juan Jose LI, Wolfgang G, Mario M,
Norman S. Chichester: John Wiley & Sons, Ltd; 2002:237.
262. Gibson SA, Korado Z, Shelton RC: oxidatieve stress en glutathion
respons in weefselkweken van personen met ernstige depressie.
J Psychiatr Res 2012, 46:1326-1332.
263. Nery FG, Monkul ES, Hatch JP, Fonseca M, Zunta-Soares GB, Frey BN,
Bowden CL, Soares JC: celecoxib als hulpmiddel bij de behandeling van
depressieve of gemengde episodes van bipolaire stoornis: een dubbelblinde,
gerandomiseerde, placebo-gecontroleerde studie. 2008, 23:87-94.
264. Levine J, Cholestoy A, Zimmerman J: Mogelijk antidepressief effect van
minocycline. 1996, 153:582.
265. Levkovitz Y, Mendlovich S, Riwkes S, Braw Y, Levkovitch-Verbin H, Gal G,
Fennig S, Treves I, Kron S: een dubbelblinde, gerandomiseerde studie van
minocycline voor de behandeling van negatieve en cognitieve symptomen bij
vroege fase schizofrenie. J Clin Psychiatrie 2010, 71: 138-149.
266. Miyaoka T, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Mogelijk antipsychotisch effect van minocycline bij patiënten met
schizofrenie. Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:304.
267. Miyaoka J, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Minocycline als aanvullende therapie voor schizofrenie: een open-label
studie. 2008, 31:287.
268. Rodriguez CI, Bender J Jr, Marcus SM, Sneep M, Rynn M, Simpson HB:
Minocycline-vergroting van farmacotherapie bij obsessief-compulsieve
stoornis: een open-label onderzoek. 2010, 71:1247-1249.
doi:10.1186/1742-2094-10-43
Citeer dit artikel als: Najjar et al.: Neuroinflammation and psychiatrische
ziekte. Journal of Neuroinflammation 2013 10:43.
Accordeon sluiten
Professionele reikwijdte van de praktijk *
De informatie hierin over "Neuroinflammation and Psychiatric Illness" is niet bedoeld ter vervanging van een een-op-een relatie met een gekwalificeerde zorgverlener of gediplomeerde arts en is geen medisch advies. We moedigen u aan om beslissingen over de gezondheidszorg te nemen op basis van uw onderzoek en samenwerking met een gekwalificeerde zorgverlener.
Blog Informatie & Scope Discussies
Ons informatiebereik: is beperkt tot chiropractie, musculoskeletale, fysieke medicijnen, welzijn, bijdragende etiologische viscerosomatische stoornissen binnen klinische presentaties, geassocieerde somatoviscerale reflex klinische dynamiek, subluxatiecomplexen, gevoelige gezondheidskwesties en/of functionele geneeskunde artikelen, onderwerpen en discussies.
Wij bieden en presenteren klinische samenwerking met specialisten uit verschillende disciplines. Elke specialist wordt beheerst door hun professionele praktijk en hun jurisdictie van licentiestatus. We gebruiken functionele gezondheids- en welzijnsprotocollen om de verwondingen of aandoeningen van het bewegingsapparaat te behandelen en te ondersteunen.
Onze video's, berichten, onderwerpen, onderwerpen en inzichten behandelen klinische zaken, problemen en onderwerpen die verband houden met en direct of indirect onze klinische praktijk ondersteunen.*
Ons kantoor heeft redelijkerwijs geprobeerd om ondersteunende citaten te geven en heeft de relevante onderzoeksstudie of studies geïdentificeerd die onze berichten ondersteunen. Wij verstrekken kopieën van ondersteunende onderzoeksstudies die op verzoek beschikbaar zijn voor regelgevende instanties en het publiek.
We begrijpen dat we zaken behandelen die een aanvullende uitleg vereisen over hoe het kan helpen bij een bepaald zorgplan of behandelprotocol; daarom, om het onderwerp hierboven verder te bespreken, aarzel dan niet om te vragen Dr. Alex Jimenez, DC, of neem contact met ons op 915-850-0900.
Wij zijn er om u en uw gezin te helpen.
zegeningen
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licentie als Doctor of Chiropractic (DC) in Texas & New Mexico*
Texas DC-licentie # TX5807, New Mexico DC-licentie # NM-DC2182
Licentie als geregistreerde verpleegkundige (RN*) in Florida
Florida-licentie RN-licentie # RN9617241 (controle nr. 3558029)
Compacte status: Licentie voor meerdere staten: Geautoriseerd om te oefenen in 40 Staten*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mijn digitale visitekaartje