1. WIE. WIE | Overgewicht en obesitas. www.who.int/gho/ncd/
risk_factors/overweight/nl/index.html. Geraadpleegd op 29 januari 2015.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. Vijf jaar GWAS-ontdekking.
Ben J Hum Genet. 2012;90:7�24.
3. Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, et al. genetisch
studies van de body mass index leveren nieuwe inzichten op voor de biologie van obesitas. Natuur.
2015; 518: 197.
4. Ling C, Del Guerra S, Lupi R, Rönn T, Granhall C, Luthman H, et al.
Epigenetische regulatie van PPARGC1A in menselijke type 2 diabetische eilandjes en
effect op de insulinesecretie. Diabetologie. 2008;51:615-22.
5. Van Dijk SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. epigenetica
en obesitas bij de mens. Int J Obes (Londen). 2015;39:85�97.
6. Teh AL, Pan H, Chen L, Ong ML, Dogra S, Wong J, et al. Het effect van
genotype en in utero-omgeving op interindividuele variatie bij pasgeborenen
DNA methylomen. Genoom onderzoek. 2014;24:1064�74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA, et al. Genoombreed
associaties tussen genetische en epigenetische variatie-invloed
mRNA-expressie en insulinesecretie in menselijke pancreaseilandjes. PLoS
Genet. 2014;10:e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A, et al.
Globale analyse van DNA-methylatievariatie in vetweefsel van tweelingen
onthult links naar ziekte-geassocieerde varianten in distale regulerende elementen.
Ben J Hum Genet. 2013;93:876�90.
9. Ronn T, Volkov P, Gillberg L, Kokosar M, Perfilyev A, Jacobsen AL, et al.
Impact van leeftijd, BMI en HbA1c-waarden op het genoombrede DNA
methylatie- en mRNA-expressiepatronen in menselijk vetweefsel
en identificatie van epigenetische biomarkers in bloed. Hum Mol Genet.
2015; 24: 3792.
10. Waterland RA, Michels KB. Epigenetische epidemiologie van de ontwikkelingsstoornissen
oorsprongshypothese. Annu Rev Nutr. 2007;27:363�88.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S, et al. De vroege oorsprong van latere obesitas: paden en mechanismen. Adv
Exp Med Biol. 2009;646:71.
12. Ravelli A, van der Meulen J, Michels R, Osmond C, Barker D, Hales C, et al.
Glucosetolerantie bij volwassenen na prenatale blootstelling aan hongersnood. Lancet.
1998; 351: 173.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Morrison JL. Ontwikkelingsoorsprong van gezondheid en ziekte bij volwassenen: de rol van
periconceptionele en foetale voeding. Basis Clin Pharmacol Toxicol.
2008; 102: 82.
14. Zhang S, Rattanatray L, McMillen IC, Suter CM, Morrison JL. Periconceptioneel
voeding en de vroege programmering van een leven met zwaarlijvigheid of tegenspoed. Prog
Biofys Mol Biol. 2011;106:307�14.
15. Bouret S, Levin BE, Ozanne SE. Gen-omgeving interacties controlerende
energie- en glucosehomeostase en de ontwikkelingsoorsprong van obesitas.
Fysiol Rev. 2015;95:47-82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM, et al.
Maternale obesitas verbetert de differentiatie van wit vetweefsel en verandert
DNA-methylatie op genoomschaal bij nakomelingen van mannelijke ratten. Endocrinologie.
2013; 154: 4113.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
et al. Metabolische plasticiteit tijdens de ontwikkeling van zoogdieren is gericht
afhankelijk van de vroege voedingsstatus. Proc Natl Acad Sci VS A.
2007; 104: 12796.
18. Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C,
et al. Epigenetische genpromotor methylatie bij de geboorte is geassocieerd met:
latere vetzucht van het kind. Suikerziekte. 2011;60:1528�34.
19. McMillen IC, Adam CL, Muhlhausler BS. Vroege oorsprong van obesitas:
programmering van het eetlustregulatiesysteem. J Fysiol. 2005;565(Pt 1):9�17.
20. Begum G, Stevens A, Smith EB, Connor K, Challis JR, Bloomfield F, et al.
Epigenetische veranderingen in de energieregulerende routes van de foetus in de hypothalamus zijn:
geassocieerd met ondervoeding van moeders en twinning. FASEB J.
2012; 26: 1694.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY, et al. zwaarlijvigheid van de moeder
en diabetes kan DNA-methylatieverandering veroorzaken in de spermatozoa van
nakomelingen bij muizen. Reprod Biol Endocrinol. 2014;12:29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A, et al.
Perinatale ondervoeding beïnvloedt de methylering en expressie van het leptine
gen bij volwassenen: implicatie voor het begrip van het metabool syndroom.
FASEB J. 2011;25:3271.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, et al.
Maternale voeding tijdens de zwangerschap induceert genexpressie en DNA
methylatieveranderingen in foetale weefsels bij schapen. Front Genet. 2013;4:49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, et al.
Maternale obesitas en diabetes veroorzaken latente metabole defecten en
wijdverbreide epigenetische veranderingen bij isogene muizen. Epigenetica. 2013;8:602�11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Dieet eiwit
beperking van drachtige ratten induceert en foliumzuursuppletie voorkomt
epigenetische modificatie van hepatische genexpressie bij het nageslacht. J Nutr.
2005; 135: 1382.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, et al. in de baarmoeder
Effecten. In utero verstoort ondervoeding het methyloom van het volwassen sperma
en intergenerationeel metabolisme. Wetenschap. 2014;345(80):1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, et al.
Epigenomica: blootstelling van de moeder aan vetrijke voeding in utero verstoort
perifere circadiane genexpressie bij niet-menselijke primaten. FASEB J.
2011; 25: 714.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA, et al. in de baarmoeder
blootstelling aan een vetrijk dieet van de moeder verandert de epigenetische histoncode in a
muismodel. Ben J Obs Gynecol. 2014;210:463 e1�463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG, et al.
Epigenetica van geprogrammeerde obesitas: verandering in IUGR rattenlever IGF1
mRNA-expressie en histonstructuur in snelle versus vertraagde postnataal
inhaalgroei. Am J Physiol Gastro-intest Lever Physiol.
2010;299:G1023.
30. Sandovici I, Smith NH, Nitert MD, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
et al. Maternale voeding en veroudering veranderen de epigenetische controle van een promotor
interactie op het Hnf4a-gen in pancreaseilandjes van ratten. Proc Natl
Acad Sci VS A. 2011;108:5449-54.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Onderzoeken naar
transgenerationele epigenetische respons langs de mannelijke lijn bij F2-varkens. PLoS
Een. 2012;7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, et al. vaderlijk
geïnduceerde transgenerationele omgevingsherprogrammering van metabole
genexpressie bij zoogdieren. Cel. 2010;143:1084-96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, et al. vaderlijk dieet
definieert nakomelingen chromatine staat en intergenerationele obesitas. Cel.
2014; 159: 1352.
34. Mart�nez D, Pentinat T, Rib� S, Daviaud C, Bloks VW, Cebri� J, et al. in de baarmoeder
ondervoeding bij mannelijke muizen programmeert leverlipidenmetabolisme in de tweede generatie
nakomelingen met veranderde Lxra-DNA-methylatie. Cel Metab.
2014; 19: 941.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H, et al. vaderlijk
geïnduceerde transgenerationele overerving van gevoeligheid voor diabetes in
zoogdieren. Proc Natl Acad Sci VS A. 2014;111:1873.
36. Grossniklaus U, Kelly WG, Kelly B, Ferguson-Smith AC, Pembrey M, Lindquist
S. Transgenerationele epigenetische overerving: hoe belangrijk is het? Nat Rev
Genet. 2013;14:228-35.
37. Pembrey M, Saffery R, Bygren LO. Menselijke transgenerationele reacties op
ervaring in het vroege leven: mogelijke impact op ontwikkeling, gezondheid en
biomedisch onderzoek. J Med Genet. 2014;51:563�72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Maternale epigenetica en methyl
supplementen beïnvloeden agouti-genexpressie bij Avy/a-muizen. FASEB J.
1998; 12: 949.
39. Jirtle RL, Skinner MK. Milieu-epigenomica en ziektegevoeligheid.
Nat Rev Genet. 2007;8:253.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Epigenetische overerving bij
de agouti-locus in de muis. Nat Genet. 1999;23:314�8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Epigenetische kiemlijn
wijziging van het muizen A vy allel door voedingssuppletie. Proc
Natl Acad Sci VS A. 2006;103:17308-12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Dieet eiwit
beperking tijdens F0-zwangerschap bij ratten induceert transgenerationele veranderingen in
het hepatische transcriptoom bij vrouwelijke nakomelingen. PLoS Een. 2011;6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P, et al. muismens
experimentele epigenetische analyse ontmaskert voedingsdoelen en
genetische aansprakelijkheid voor diabetische fenotypes. Cel Metab. 2015;21:138-49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, et al.
Aanbevelingen voor het ontwerp en de analyse van epigenoom-breed
associatiestudies. Nat methoden. 2013;10:949.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, R�nn T, Ling C. Identificatie van
CpG-SNP's geassocieerd met diabetes type 2 en differentiële DNA-methylatie
in menselijke pancreaseilandjes. Diabetologie. 2013;56:1036�46.
46. Relton CL, Davey Smith G. Epigenetische Mendeliaanse randomisatie in twee stappen: a
strategie voor het vaststellen van de causale rol van epigenetische processen in paden
tot ziekte. Int J Epidemiol. 2012;41:161-76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, et al.
Epigenoom-brede associatiegegevens impliceren DNA-methylatie als een
intermediair van genetisch risico bij reumatoïde artritis. Nat Biotechnologie.
2013; 31: 142.
48. Yuan W, Xia Y, Bell CG, Toch I, Ferreira T, Ward KJ, et al. Een geïntegreerde
epigenomische analyse voor loci voor type 2 diabetesgevoeligheid in monozygote
Tweelingen. Nat Comm. 2014;5:5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, et al. Impact van een
oefeninterventie op DNA-methylatie in skeletspier van eerstegraads
familieleden van patiënten met diabetes type 2. Suikerziekte. 2012;61:3322-32.
50. Gagnon F, A�ssi D, Carri� A, Morange PE, Tr�gou�t DA. Robuuste validatie van
associatie van methylatieniveaus op de CPT1A-locus met lipideplasmaspiegels.
J Lipide Res. 2014;55:1189.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
et al. Epigenoombrede associatiestudie (EWAS) van BMI, BMI-verandering en
tailleomtrek bij Afro-Amerikaanse volwassenen identificeert meerdere gerepliceerd
plaats. Hum Mol Genet. 2015:ddv161�.
52. Dick KJ, Nelson CP, Tsaprouni L, Sandling JK, Assi D, Wahl S, et al. DNA
methylatie en body-mass index: een genoombrede analyse. Lancet.
2014; 6736: 1.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G, et al. DNA-methylering van
het LY86-gen is geassocieerd met obesitas, insulineresistentie en
ontsteking. Twin Res Hum Genet. 2014;17:183-91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, et al.
PGC1? promotor methylering in bloed op 5 jaar voorspelt adipositas van
9 tot 14 jaar (EarlyBird 50). Suikerziekte. 2014;63:2528-37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, et al.
ADRB3-genpromotor DNA-methylatie in bloed en visceraal vet
weefsel wordt geassocieerd met metabole stoornissen bij mannen. Epigenomica.
2014; 6: 33.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. Vetzucht is
geassocieerd met DNA-methylatieprofiel in vetweefsel. Int J Epidemiol.
2014: 1.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA, et al.
Epigenoom-brede associatiestudie van nuchtere bloedlipiden in de genetica van
lipidenverlagende medicijnen en voedingsnetwerkstudie. Circulatie. 2014;130:565�72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY, et al.
Methylering op de CPT1A-locus is geassocieerd met lipoproteïne-subfractie
profielen. J Lipide Res. 2014;55:1324�30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, et al. DNA
methylering van lipide-gerelateerde genen beïnvloedt de lipideniveaus in het bloed. Circ cardiovasculaire
Genet. 2015.
60. Petersen AK, Zeilinger S, Kastenmüller G, Rmisch-Margl W, Brugger M, Peters
A, et al. Epigenetica ontmoet metabolomics: een epigenoombrede associatie
studie met bloedserum metabolische eigenschappen. Hum Mol Genet. 2014;23:534�45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D, et al. Epigenoombreed
associatiestudie van nuchtere metingen van glucose, insuline en HOMA-IR
in de genetica van lipidenverlagende medicijnen en voedingsnetwerkstudie. Suikerziekte.
2014; 63: 801.
62. Dayeh T, Volkov P, Salé S, Hall E, Nilsson E, Olsson AH, et al. Genoombreed
DNA-methylatie-analyse van menselijke pancreaseilandjes van diabetes type 2
en niet-diabetische donoren identificeren kandidaatgenen die insuline beïnvloeden
afscheiding. PLoS Genet. 2014;10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK, et al.
Veranderde DNA-methylatie en differentiële expressie van genen die van invloed zijn
stofwisseling en ontsteking in vetweefsel van personen met type 2
suikerziekte. Suikerziekte. 2014;63:2962-76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA, et al. Een analyse van DNA-methylatie in menselijk vetweefsel onthult differentiële modificatie van obesitas-genen voor en na maagbypass en gewicht
verlies. Gen. 2015;16:1�21.
65. Bateson P, Gluckman P. Plasticiteit en robuustheid in ontwikkeling en
evolutie. Int J Epidemiol. 2012;41:219-23.
66. Feinberg AP, Irizarry RA, Feinberg AP, Irizarry RA. Evolutie in gezondheid en
geneeskunde Sackler colloquium: stochastische epigenetische variatie als drijfveer
ontwikkelingskracht, evolutionaire aanpassing en ziekte. Proc Natl Acad
Sci VS A. 2010;107(Suppl):1757-64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, Cruickshank MN, Saffery R, et al.
Longitudinale analyse op genoomschaal van DNA-methylatie bij tweelingen vanaf de geboorte
tot 18 maanden oud onthult snelle epigenetische verandering in het vroege leven en paarspecifiek
gevolgen van onenigheid. Genoom Biol. 2013;14:R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y, et al. DNA
methylatiesignaturen koppelen prenatale hongersnoodblootstelling aan groei en
metabolisme. Nat Comm. 2014;5:5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA, et al.
Maternale voeding bij de conceptie moduleert DNA-methylatie van de mens
metastabiele epiallelen. Nat Comm. 2014;5:3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, et al.
Impact op de methylatiepatronen van nakomelingen van zwangerschapsdiabetes bij de moeder
mellitus en intra-uteriene groeiremming suggereren gemeenschappelijke genen en
paden die verband houden met het daaropvolgende risico op diabetes type 2. FASEB J. 2014:1�12.
71. Morales E, Bruidegom A, Lawlor DA, Relton CL. DNA methylatie handtekeningen in
navelstrengbloed geassocieerd met gewichtstoename tijdens zwangerschap van de moeder: resultaten van:
het ALSPAC-cohort. BMC Res-opmerkingen. 2014;7:278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, et al.
Zwangerschapsdiabetes mellitus beïnvloedt epigenetisch voornamelijk genen
betrokken bij stofwisselingsziekten. Epigenetica. 2013;8:935�43.
73. Liu X, Chen Q, Tsai HJ, Wang G, Hong X, Zhou Y, et al. moederlijk
preconceptie body mass index en nakomelingen navelstrengbloed DNA
methylering: onderzoek naar de oorsprong van ziekten in het vroege leven. omgeving Mol
mutageen. 2014;55:223�30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF, et al.
Pasgeborenen van zwaarlijvige ouders hebben veranderde DNA-methylatiepatronen bij
ingeprente genen. Int J Obes (Londen). 2015;39:650�7.
75. Jacobsen SC, Brns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, et al.
Effecten van kortdurende overvoeding met veel vet op genoombreed DNA
methylering in de skeletspier van gezonde jonge mannen. Diabetologie.
2012; 55: 3341.
76. Gillberg L, Jacobsen SC, R�nn T, Br�ns C, Vaag A. PPARGC1A DNA
methylering in onderhuids vetweefsel bij personen met een laag geboortegewicht�
effect van 5 dagen vetrijke overvoeding. Metabolisme. 2014;63:263�71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Epigenetische patronen bij succesvolle handhavers van gewichtsverlies: een pilootstudie. Int J
Obes (Londen). 2015;39:865�8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N�slund E,
Zierath Jr. Gewichtsverlies na maagbypassoperatie bij menselijke obesitas
hermodelleert promotormethylering. Celvertegenwoordiger 2013:1�8.
79. Ahrens M, Ammerpohl O, von Schönfels W, Kolarova J, Bens S, Itzel T, et al.
DNA-methylatie-analyse bij niet-alcoholische leververvetting suggereert:
verschillende ziektespecifieke en remodellerende handtekeningen na bariatrische chirurgie.
Cel Metab. 2013;18:296.
80. Voisin S, Eynon N, Yan X, Bisschop DJ. Trainingstraining en DNA-methylatie
in mensen. Acta Fysiol (Oxf). 2014;213:39�59.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekström TJ,
Tegnér J, et al. Een integratieve analyse onthult gecoördineerde herprogrammering
van het epigenoom en het transcriptoom in de menselijke skeletspier na
opleiding. Epigenetica. 2014;9:1557-69.
82. Denham J, O'Brien BJ, Marques FZ, Charchar FJ. Veranderingen in de leukocyten
methylome en het effect ervan op cardiovasculaire gerelateerde genen na inspanning.
J Appl Fysiol. 2014:jap.00878.2014.
83. Rowlands DS, Page RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I, et al.
Multi-omic geïntegreerde netwerken verbinden DNA-methylatie en miRNA met
skeletspierplasticiteit tot chronische inspanning bij diabetes type 2 obesitas.
Fysiol Genomics. 2014;46:747-65.
84. Horvath S, Erhart W, Brosch M, Ammerpohl O, von Schonfels W, Ahrens M,
et al. Obesitas versnelt epigenetische veroudering van de menselijke lever. Proc Natl Acad
wetenschap 2014;111:15538-43.
85. Almán MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
Genoombrede analyse onthult DNA-methylatiemarkers die variëren met
zowel leeftijd als obesitas. Gen. 2014.;548:61�7
86. Houseman EA, Molitor J, Marsit CJ. Aanpassingen van het referentievrije celmengsel
bij de analyse van DNA-methylatiegegevens. Bio-informatica. 2014;30:1431.
87. Wells JC. Een kritische beoordeling van de voorspellende adaptieve responshypothese.
Int J Epidemiol. 2012;41:229-35.
88. Williams-Wyss O, Zhang S, MacLaughlin SM, Kleemann D, Walker SK, Suter
CM, et al. Embryonummer en periconceptionele ondervoeding in de
schapen hebben verschillende effecten op het bijnierepigenotype, de groei en
ontwikkeling. Am J Physiol Endocrinol Metab. 2014;307:E141-50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
Maternale obesitas en de vroege oorsprong van obesitas bij kinderen: een afweging
de voordelen en kosten van gewichtsverlies bij de moeder in de periconceptionele
periode voor het nageslacht. Exp Diabetes Res. 2011;2011:585749.
90. Zhang S, Williams-Wyss O, MacLaughlin SM, Walker SK, Kleemann DO, Suter
CM, et al. Maternale ondervoeding in de eerste week na de conceptie
resulteert in verminderde expressie van glucocorticoïdreceptor-mRNA in de
afwezigheid van GR exon 17 hypermethylering in de foetale hypofyse in de late
zwangerschap. J Dev Orig Heal Dis. 2013;4:391-401.
91. Lie S, Morrison JL, Williams-Wyss O, Suter CM, Humphreys DT, Ozanne SE,
et al. Periconceptionele ondervoedingsprogramma's veranderingen in insulinesignalering
moleculen en microRNA's in skeletspieren bij eenling en tweelingfoetale
schaap. Biol Reprod. 2014;90:5.
92. Van Straten EM, van Meer H, Huijkman NC, van Dijk TH, Baller JF, Verkade
HJ, et al. Foetale lever X-receptoractivering induceert acuut lipogenese, maar
heeft geen invloed op de plasmalipiderespons op een vetrijk dieet bij volwassen muizen. ben J
Fysiol Endocrinol Metab. 2009;297:E1171.
93. Fernandez-Twinn DS, Alfaradhi MZ, Martin-Gronert MS, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D, et al. Downregulatie van IRS-1 in
vetweefsel van nakomelingen van zwaarlijvige muizen wordt celautonoom geprogrammeerd
via post-transcriptionele mechanismen. Mol Metab.
2014; 3: 325.
94. Waterland RA, Travisano M, Tahiliani KG. Door voeding geïnduceerde hypermethylering bij
agouti levensvatbaar geel wordt niet transgenerationeel overgeërfd via het vrouwtje.
FASEB J. 2007;21:3380.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC, et al. DNA methylering in
eicellen en lever van vrouwelijke muizen en hun nakomelingen: effecten van vetrijke voeding
zwaarlijvigheid. Env Heal Perspectief. 2014;122:159.
96. Ollikainen M, Ismail K, Gervin K, Kyllénen A, Hakkarainen A, Lundbom J, et al.
Genoombrede bloed-DNA-methylatieveranderingen bij regulerende elementen
en heterochromatische regio's in monozygote tweelingen die niet overeenstemmen met obesitas
en levervet. Clin Epigenetica. 2015;7:1�13.




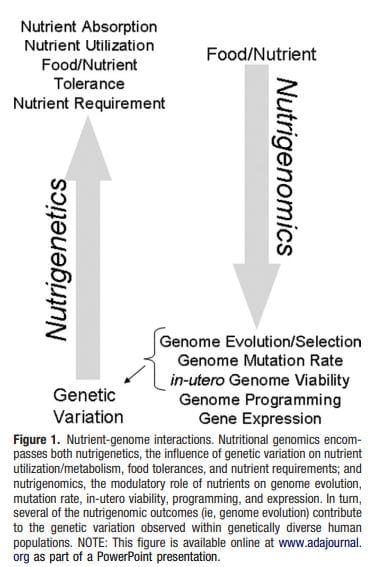




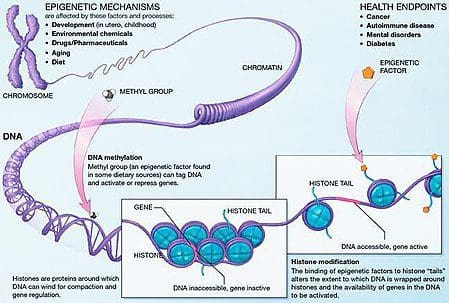 Obesitas is een complexe, multifactoriële ziekte en een beter begrip van de mechanismen die ten grondslag liggen aan de interacties tussen levensstijl, omgeving en genetica is van cruciaal belang voor het ontwikkelen van effectieve strategieën voor preventie en behandeling [1].
Obesitas is een complexe, multifactoriële ziekte en een beter begrip van de mechanismen die ten grondslag liggen aan de interacties tussen levensstijl, omgeving en genetica is van cruciaal belang voor het ontwikkelen van effectieve strategieën voor preventie en behandeling [1]. Diermodellen bieden unieke kansen voor sterk gecontroleerde studies die mechanistisch inzicht verschaffen in de rol van specifieke epigenetische kenmerken, zowel als indicatoren van de huidige metabole status als als voorspellers van het toekomstige risico op obesitas en stofwisselingsziekten. Een bijzonder belangrijk aspect van dierstudies is dat ze de beoordeling mogelijk maken van epigenetische veranderingen in doelweefsels, waaronder de lever en hypothalamus, wat veel moeilijker is bij mensen. Bovendien maakt het vermogen om grote hoeveelheden vers weefsel te oogsten het mogelijk om meerdere chromatinemarkeringen en DNA-methylatie te beoordelen. Sommige van deze epigenetische modificaties, alleen of in combinatie, kunnen reageren op omgevingsprogrammering. In diermodellen is het ook mogelijk om meerdere generaties nakomelingen te bestuderen en zo differentiatie mogelijk te maken tussen transgenerationele en intergenerationele overdracht van obesitasrisico gemedieerd door epigenetisch geheugen van de ouderlijke voedingsstatus, die niet gemakkelijk kan worden onderscheiden in studies bij mensen. We gebruiken de eerste term voor meiotische overdracht van risico in afwezigheid van voortdurende blootstelling, terwijl de laatste voornamelijk directe overdracht van risico inhoudt door metabole herprogrammering van de foetus of gameten.
Diermodellen bieden unieke kansen voor sterk gecontroleerde studies die mechanistisch inzicht verschaffen in de rol van specifieke epigenetische kenmerken, zowel als indicatoren van de huidige metabole status als als voorspellers van het toekomstige risico op obesitas en stofwisselingsziekten. Een bijzonder belangrijk aspect van dierstudies is dat ze de beoordeling mogelijk maken van epigenetische veranderingen in doelweefsels, waaronder de lever en hypothalamus, wat veel moeilijker is bij mensen. Bovendien maakt het vermogen om grote hoeveelheden vers weefsel te oogsten het mogelijk om meerdere chromatinemarkeringen en DNA-methylatie te beoordelen. Sommige van deze epigenetische modificaties, alleen of in combinatie, kunnen reageren op omgevingsprogrammering. In diermodellen is het ook mogelijk om meerdere generaties nakomelingen te bestuderen en zo differentiatie mogelijk te maken tussen transgenerationele en intergenerationele overdracht van obesitasrisico gemedieerd door epigenetisch geheugen van de ouderlijke voedingsstatus, die niet gemakkelijk kan worden onderscheiden in studies bij mensen. We gebruiken de eerste term voor meiotische overdracht van risico in afwezigheid van voortdurende blootstelling, terwijl de laatste voornamelijk directe overdracht van risico inhoudt door metabole herprogrammering van de foetus of gameten.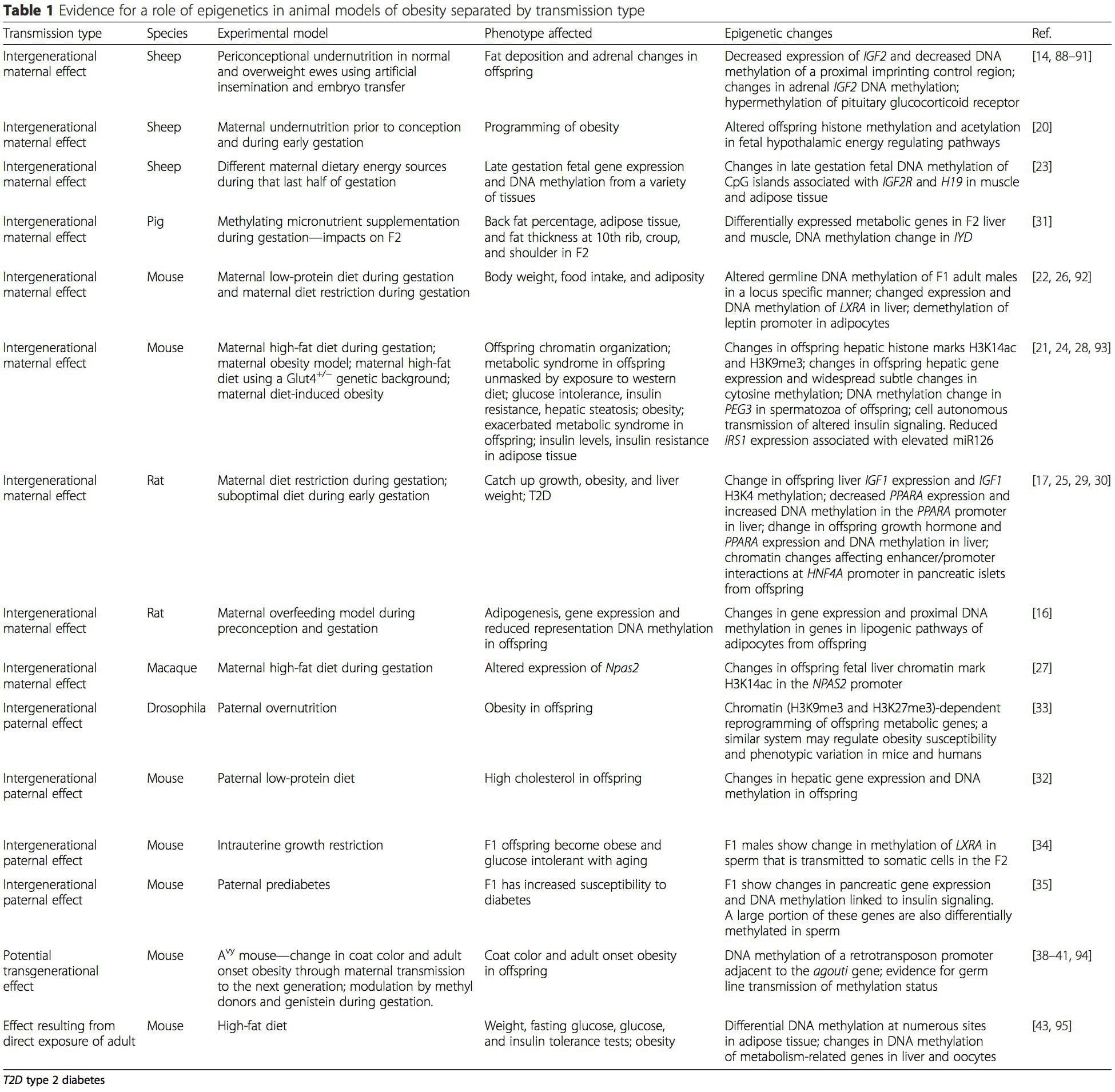 (i) Epigenetische veranderingen bij nakomelingen in verband met voeding van de moeder tijdens de zwangerschap
(i) Epigenetische veranderingen bij nakomelingen in verband met voeding van de moeder tijdens de zwangerschap Maternale voedingssuppletie, ondervoeding en overvoeding tijdens de zwangerschap kunnen de vetafzetting en energiehomeostase bij het nageslacht veranderen [11, 13, 15]. Geassocieerd met deze effecten bij het nageslacht zijn veranderingen in DNA-methylatie, histon-post-translationele modificaties en genexpressie voor verschillende doelwitgenen, met name genen die het vetzuurmetabolisme en insulinesignalering reguleren [19, 16, 17-20]. De diversiteit aan diermodellen die in deze onderzoeken zijn gebruikt en de gemeenschappelijke metabole routes die worden beïnvloed, suggereren een evolutionair geconserveerde adaptieve respons die wordt gemedieerd door epigenetische modificatie. Er zijn echter maar weinig van de specifiek geïdentificeerde genen en epigenetische veranderingen kruisgevalideerd in gerelateerde onderzoeken, en grootschalige genoombrede onderzoeken zijn meestal niet toegepast. Een belangrijke belemmering voor het vergelijken van deze onderzoeken zijn de verschillende mentale ontwikkelingsvensters die onderhevig zijn aan voedingsuitdagingen, die aanzienlijk verschillende resultaten kunnen veroorzaken. Bewijs dat de epigenetische veranderingen causaal zijn in plaats van geassocieerd te zijn met fenotypische veranderingen van het nageslacht is ook vereist. Dit vereist de identificatie van een door de ouder veroorzaakte epigenetische 'geheugen'-reactie die voorafgaat aan de ontwikkeling van het veranderde fenotype bij het nageslacht.
Maternale voedingssuppletie, ondervoeding en overvoeding tijdens de zwangerschap kunnen de vetafzetting en energiehomeostase bij het nageslacht veranderen [11, 13, 15]. Geassocieerd met deze effecten bij het nageslacht zijn veranderingen in DNA-methylatie, histon-post-translationele modificaties en genexpressie voor verschillende doelwitgenen, met name genen die het vetzuurmetabolisme en insulinesignalering reguleren [19, 16, 17-20]. De diversiteit aan diermodellen die in deze onderzoeken zijn gebruikt en de gemeenschappelijke metabole routes die worden beïnvloed, suggereren een evolutionair geconserveerde adaptieve respons die wordt gemedieerd door epigenetische modificatie. Er zijn echter maar weinig van de specifiek geïdentificeerde genen en epigenetische veranderingen kruisgevalideerd in gerelateerde onderzoeken, en grootschalige genoombrede onderzoeken zijn meestal niet toegepast. Een belangrijke belemmering voor het vergelijken van deze onderzoeken zijn de verschillende mentale ontwikkelingsvensters die onderhevig zijn aan voedingsuitdagingen, die aanzienlijk verschillende resultaten kunnen veroorzaken. Bewijs dat de epigenetische veranderingen causaal zijn in plaats van geassocieerd te zijn met fenotypische veranderingen van het nageslacht is ook vereist. Dit vereist de identificatie van een door de ouder veroorzaakte epigenetische 'geheugen'-reactie die voorafgaat aan de ontwikkeling van het veranderde fenotype bij het nageslacht. Opkomende studies hebben aangetoond dat het voedingsniveau van de vader van invloed kan zijn op de vetafzetting en epigenetische kenmerken van het nageslacht [31-34]. Een recent onderzoek met muizen heeft aangetoond dat pre-diabetes van de vader leidt tot verhoogde vatbaarheid voor diabetes bij F1-nakomelingen met bijbehorende veranderingen in pancreasgenexpressie en DNA-methylatie gekoppeld aan insulinesignalering [35]. Belangrijk is dat er een overlap was van deze epigenetische veranderingen in pancreaseilandjes en sperma, wat duidt op overerving van de kiemlijn. De meeste van deze onderzoeken, hoewel intrigerend in hun implicaties, zijn echter beperkt in de genomische onderzoeksschaal en vertonen vaak zwakke en enigszins voorbijgaande epigenetische veranderingen die verband houden met milde metabole fenotypes bij nakomelingen.
Opkomende studies hebben aangetoond dat het voedingsniveau van de vader van invloed kan zijn op de vetafzetting en epigenetische kenmerken van het nageslacht [31-34]. Een recent onderzoek met muizen heeft aangetoond dat pre-diabetes van de vader leidt tot verhoogde vatbaarheid voor diabetes bij F1-nakomelingen met bijbehorende veranderingen in pancreasgenexpressie en DNA-methylatie gekoppeld aan insulinesignalering [35]. Belangrijk is dat er een overlap was van deze epigenetische veranderingen in pancreaseilandjes en sperma, wat duidt op overerving van de kiemlijn. De meeste van deze onderzoeken, hoewel intrigerend in hun implicaties, zijn echter beperkt in de genomische onderzoeksschaal en vertonen vaak zwakke en enigszins voorbijgaande epigenetische veranderingen die verband houden met milde metabole fenotypes bij nakomelingen.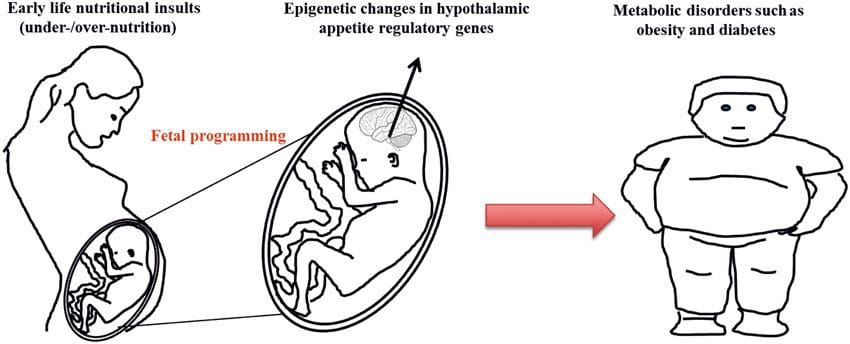 Stabiele overdracht van epigenetische informatie over meerdere generaties is goed beschreven in plantensystemen en C. elegans, maar de betekenis ervan bij zoogdieren wordt nog steeds veel besproken [36, 37]. Een epigenetische basis voor de overdracht van fenotypes door grootouders als reactie op blootstelling via de voeding is goed vastgesteld, ook bij diersoorten [31]. De meest invloedrijke studies die effecten aantonen van epigenetische overdracht die het fenotype van nakomelingen beïnvloeden, hebben het voorbeeld van de levensvatbare gele agouti (Avy) muis [38] gebruikt. Bij deze muis veroorzaakt een insertie van een retrotransposon stroomopwaarts van het agouti-gen de constitutieve expressie en de daaruit voortvloeiende gele vachtkleur en zwaarlijvigheid bij volwassenen. Maternale transmissie via de kiemlijn resulteert in DNA-methylatie, gemedieerde silencing van agouti-expressie, resulterend in wildtype vachtkleur en mager fenotype van het nageslacht [39, 40]. Belangrijk is dat latere studies bij deze muizen aantoonden dat blootstelling van de moeder aan methyldonoren een verschuiving in vachtkleur veroorzaakt [41]. Eén studie heeft de overdracht van een fenotype naar de F3-generatie en veranderingen in de expressie van een groot aantal genen gerapporteerd als reactie op eiwitbeperking in F0 [42]; veranderingen in expressie waren echter zeer variabel en een directe link naar epigenetische veranderingen werd in dit systeem niet geïdentificeerd.
Stabiele overdracht van epigenetische informatie over meerdere generaties is goed beschreven in plantensystemen en C. elegans, maar de betekenis ervan bij zoogdieren wordt nog steeds veel besproken [36, 37]. Een epigenetische basis voor de overdracht van fenotypes door grootouders als reactie op blootstelling via de voeding is goed vastgesteld, ook bij diersoorten [31]. De meest invloedrijke studies die effecten aantonen van epigenetische overdracht die het fenotype van nakomelingen beïnvloeden, hebben het voorbeeld van de levensvatbare gele agouti (Avy) muis [38] gebruikt. Bij deze muis veroorzaakt een insertie van een retrotransposon stroomopwaarts van het agouti-gen de constitutieve expressie en de daaruit voortvloeiende gele vachtkleur en zwaarlijvigheid bij volwassenen. Maternale transmissie via de kiemlijn resulteert in DNA-methylatie, gemedieerde silencing van agouti-expressie, resulterend in wildtype vachtkleur en mager fenotype van het nageslacht [39, 40]. Belangrijk is dat latere studies bij deze muizen aantoonden dat blootstelling van de moeder aan methyldonoren een verschuiving in vachtkleur veroorzaakt [41]. Eén studie heeft de overdracht van een fenotype naar de F3-generatie en veranderingen in de expressie van een groot aantal genen gerapporteerd als reactie op eiwitbeperking in F0 [42]; veranderingen in expressie waren echter zeer variabel en een directe link naar epigenetische veranderingen werd in dit systeem niet geïdentificeerd.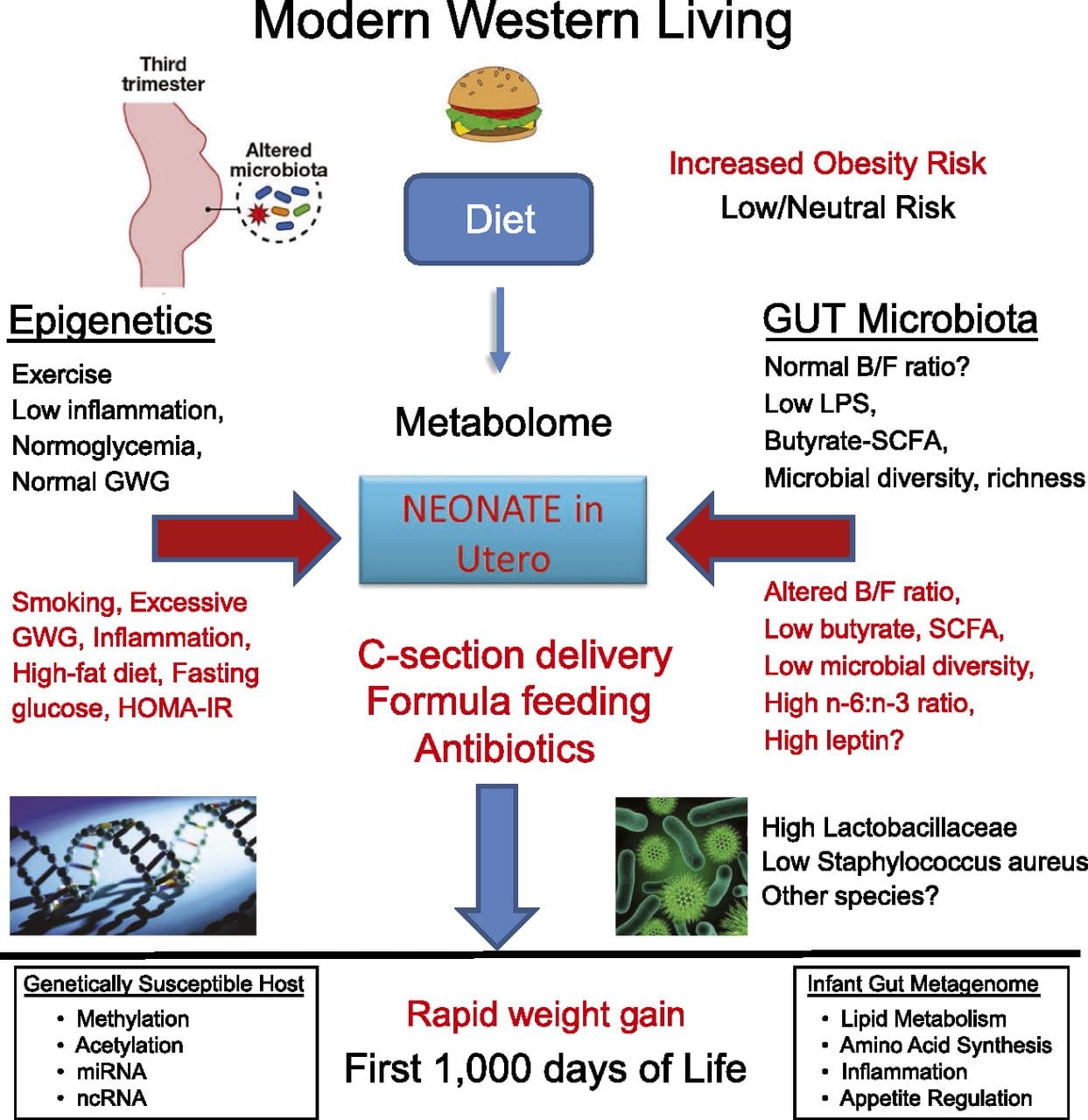 Hoewel veel studies dieetgerelateerde epigenetische veranderingen in diermodellen hebben geïdentificeerd met behulp van kandidaat-plaatsspecifieke regio's, zijn er weinig genoombrede analyses uitgevoerd. Een recent onderzoek was gericht op het bepalen van de directe epigenetische impact van vetrijke diëten/dieet-geïnduceerde obesitas bij volwassen muizen met behulp van genoombrede genexpressie en DNA-methylatieanalyses [43]. Deze studie identificeerde 232 differentieel gemethyleerde regio's (DMR's) in adipocyten van controle- en vetrijke muizen. Belangrijk is dat de overeenkomstige menselijke regio's voor de muizen-DMR's ook differentieel gemethyleerd waren in vetweefsel van een populatie van zwaarlijvige en magere mensen, waardoor het opmerkelijke evolutionaire behoud van deze regio's wordt benadrukt. Dit resultaat benadrukt het waarschijnlijke belang van de geïdentificeerde DMR's bij het reguleren van energiehomeostase bij zoogdieren.
Hoewel veel studies dieetgerelateerde epigenetische veranderingen in diermodellen hebben geïdentificeerd met behulp van kandidaat-plaatsspecifieke regio's, zijn er weinig genoombrede analyses uitgevoerd. Een recent onderzoek was gericht op het bepalen van de directe epigenetische impact van vetrijke diëten/dieet-geïnduceerde obesitas bij volwassen muizen met behulp van genoombrede genexpressie en DNA-methylatieanalyses [43]. Deze studie identificeerde 232 differentieel gemethyleerde regio's (DMR's) in adipocyten van controle- en vetrijke muizen. Belangrijk is dat de overeenkomstige menselijke regio's voor de muizen-DMR's ook differentieel gemethyleerd waren in vetweefsel van een populatie van zwaarlijvige en magere mensen, waardoor het opmerkelijke evolutionaire behoud van deze regio's wordt benadrukt. Dit resultaat benadrukt het waarschijnlijke belang van de geïdentificeerde DMR's bij het reguleren van energiehomeostase bij zoogdieren.
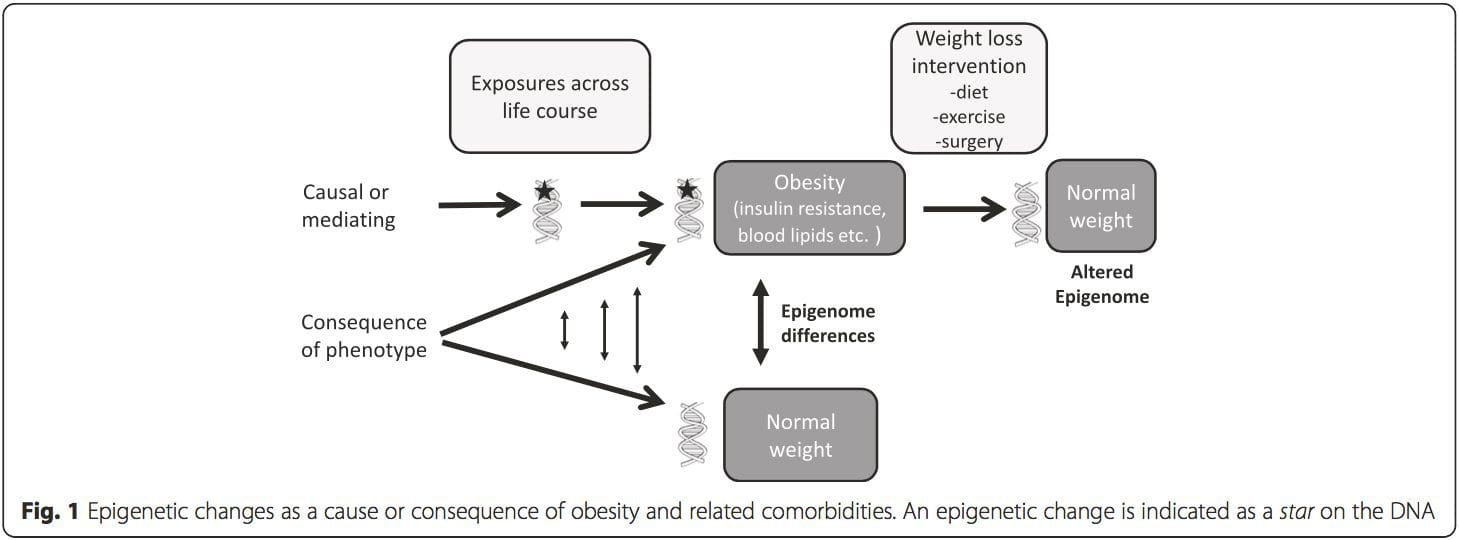 (i) Genetische associatiestudies. Genetische polymorfismen die geassocieerd zijn met een verhoogd risico op het ontwikkelen van bepaalde aandoeningen zijn a priori gekoppeld aan de oorzakelijke genen. De aanwezigheid van differentiële methylering in dergelijke regio's leidt tot functionele relevantie van deze epigenetische veranderingen bij het beheersen van de expressie van het (de) proximale gen (genen). Er zijn sterke cis-werkende genetische effecten die ten grondslag liggen aan veel epigenetische variatie [7, 45], en in populatiegebaseerde studies zijn methoden toegepast die genetische surrogaten gebruiken om een causale of mediërende rol van epigenoomverschillen af te leiden [7, 46-48] . Het gebruik van familiale genetische informatie kan ook leiden tot de identificatie van potentieel oorzakelijke kandidaatregio's die fenotype-gerelateerde differentiële methylering vertonen [49].
(i) Genetische associatiestudies. Genetische polymorfismen die geassocieerd zijn met een verhoogd risico op het ontwikkelen van bepaalde aandoeningen zijn a priori gekoppeld aan de oorzakelijke genen. De aanwezigheid van differentiële methylering in dergelijke regio's leidt tot functionele relevantie van deze epigenetische veranderingen bij het beheersen van de expressie van het (de) proximale gen (genen). Er zijn sterke cis-werkende genetische effecten die ten grondslag liggen aan veel epigenetische variatie [7, 45], en in populatiegebaseerde studies zijn methoden toegepast die genetische surrogaten gebruiken om een causale of mediërende rol van epigenoomverschillen af te leiden [7, 46-48] . Het gebruik van familiale genetische informatie kan ook leiden tot de identificatie van potentieel oorzakelijke kandidaatregio's die fenotype-gerelateerde differentiële methylering vertonen [49].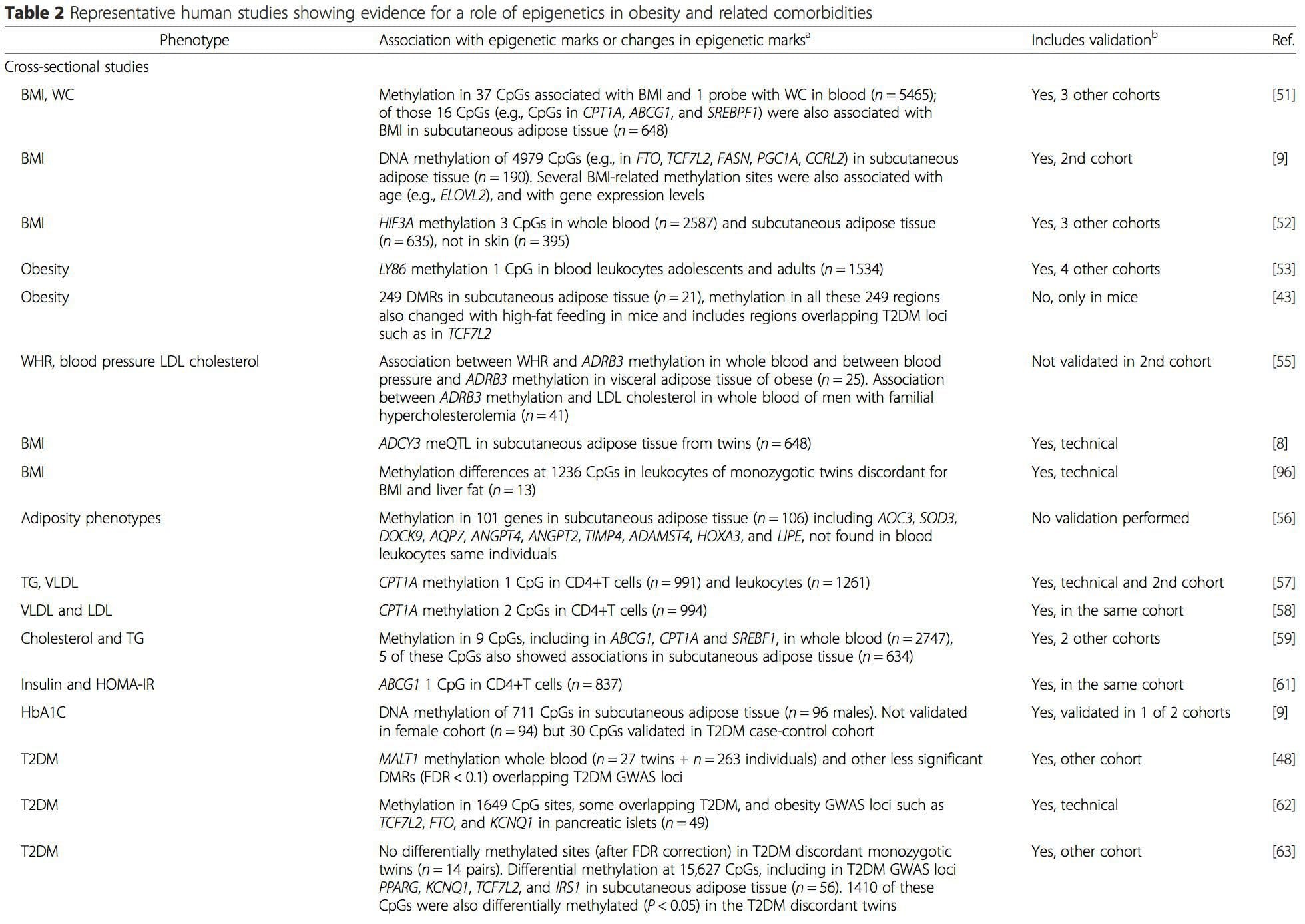
 Uit deze studies zijn veranderde methylering van PGC1A, HIF3A, ABCG1 en CPT1A en de eerder beschreven RXRA [18] naar voren gekomen als biomarkers die geassocieerd zijn met, of misschien voorspellend zijn voor, metabole gezondheid die ook plausibele kandidaten zijn voor een rol bij de ontwikkeling van metabole ziekten .
Uit deze studies zijn veranderde methylering van PGC1A, HIF3A, ABCG1 en CPT1A en de eerder beschreven RXRA [18] naar voren gekomen als biomarkers die geassocieerd zijn met, of misschien voorspellend zijn voor, metabole gezondheid die ook plausibele kandidaten zijn voor een rol bij de ontwikkeling van metabole ziekten .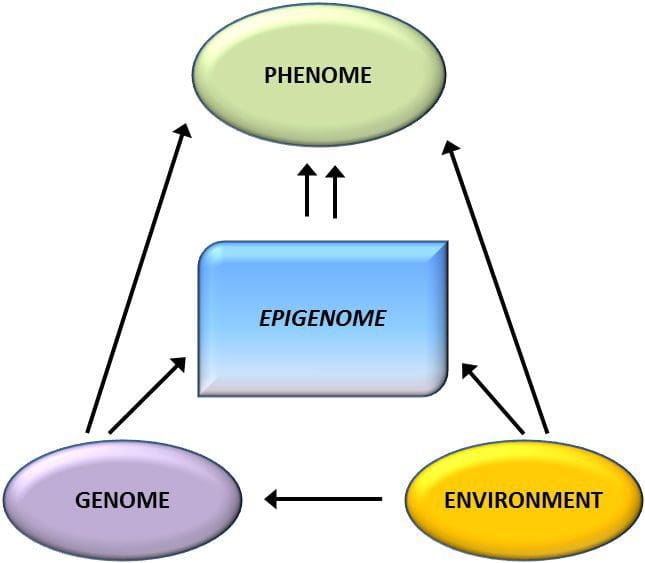 Epigenetische variatie wordt sterk beïnvloed door de onderliggende genetische variatie, waarbij het genotype naar schatting ~20-40% van de variatie verklaart [6, 8]. Onlangs zijn een aantal onderzoeken begonnen met het integreren van methyloom- en genotypegegevens om methylatie-kwantitatief kenmerk-loci (meQTL) te identificeren die verband houden met ziektefenotypes. In vetweefsel is bijvoorbeeld een meQTL die overlapt met een BMI genetische risicolocus geïdentificeerd in een enhancer-element stroomopwaarts van ADCY3 [8]. Andere studies hebben ook overlappingen geïdentificeerd tussen bekende obesitas en T2DM-risicoloci en DMR's geassocieerd met obesitas en T2DM [43, 48, 62]. Methylering van een aantal van dergelijke DMR's werd ook gemoduleerd door vetrijke voeding bij muizen [43] en gewichtsverlies bij mensen [64]. Deze resultaten identificeren een intrigerend verband tussen genetische variaties die verband houden met ziektegevoeligheid en hun associatie met regio's van het genoom die epigenetische modificaties ondergaan als reactie op voedingsuitdagingen, wat een oorzakelijk verband impliceert. Het nauwe verband tussen genetische en epigenetische variatie kan duiden op hun essentiële rol bij het genereren van individuele variatie [65, 66]. Hoewel deze bevindingen suggereren dat DNA-methylatie een mediator kan zijn van genetische effecten, is het ook belangrijk om te bedenken dat zowel genetische als epigenetische processen onafhankelijk van elkaar op dezelfde genen kunnen werken. Tweelingstudies [8, 63, 67] kunnen belangrijke inzichten verschaffen en aangeven dat interindividuele verschillen in niveaus van DNA-methylatie voornamelijk voortkomen uit niet-gedeelde omgeving en stochastische invloeden, minimaal uit gedeelde omgevingseffecten, maar ook met een significante impact van genetische variatie.
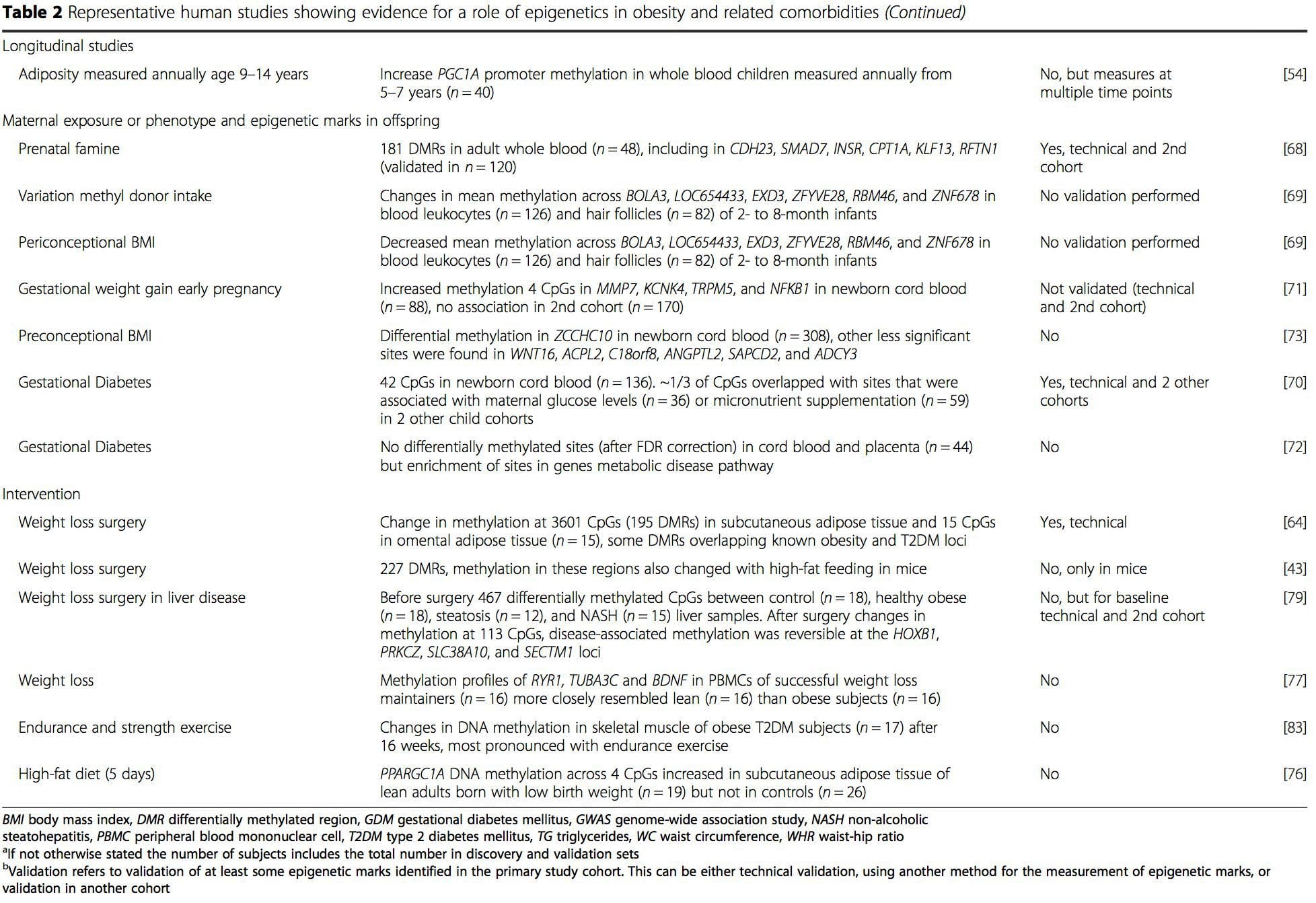
Epigenetische variatie wordt sterk beïnvloed door de onderliggende genetische variatie, waarbij het genotype naar schatting ~20-40% van de variatie verklaart [6, 8]. Onlangs zijn een aantal onderzoeken begonnen met het integreren van methyloom- en genotypegegevens om methylatie-kwantitatief kenmerk-loci (meQTL) te identificeren die verband houden met ziektefenotypes. In vetweefsel is bijvoorbeeld een meQTL die overlapt met een BMI genetische risicolocus geïdentificeerd in een enhancer-element stroomopwaarts van ADCY3 [8]. Andere studies hebben ook overlappingen geïdentificeerd tussen bekende obesitas en T2DM-risicoloci en DMR's geassocieerd met obesitas en T2DM [43, 48, 62]. Methylering van een aantal van dergelijke DMR's werd ook gemoduleerd door vetrijke voeding bij muizen [43] en gewichtsverlies bij mensen [64]. Deze resultaten identificeren een intrigerend verband tussen genetische variaties die verband houden met ziektegevoeligheid en hun associatie met regio's van het genoom die epigenetische modificaties ondergaan als reactie op voedingsuitdagingen, wat een oorzakelijk verband impliceert. Het nauwe verband tussen genetische en epigenetische variatie kan duiden op hun essentiële rol bij het genereren van individuele variatie [65, 66]. Hoewel deze bevindingen suggereren dat DNA-methylatie een mediator kan zijn van genetische effecten, is het ook belangrijk om te bedenken dat zowel genetische als epigenetische processen onafhankelijk van elkaar op dezelfde genen kunnen werken. Tweelingstudies [8, 63, 67] kunnen belangrijke inzichten verschaffen en aangeven dat interindividuele verschillen in niveaus van DNA-methylatie voornamelijk voortkomen uit niet-gedeelde omgeving en stochastische invloeden, minimaal uit gedeelde omgevingseffecten, maar ook met een significante impact van genetische variatie.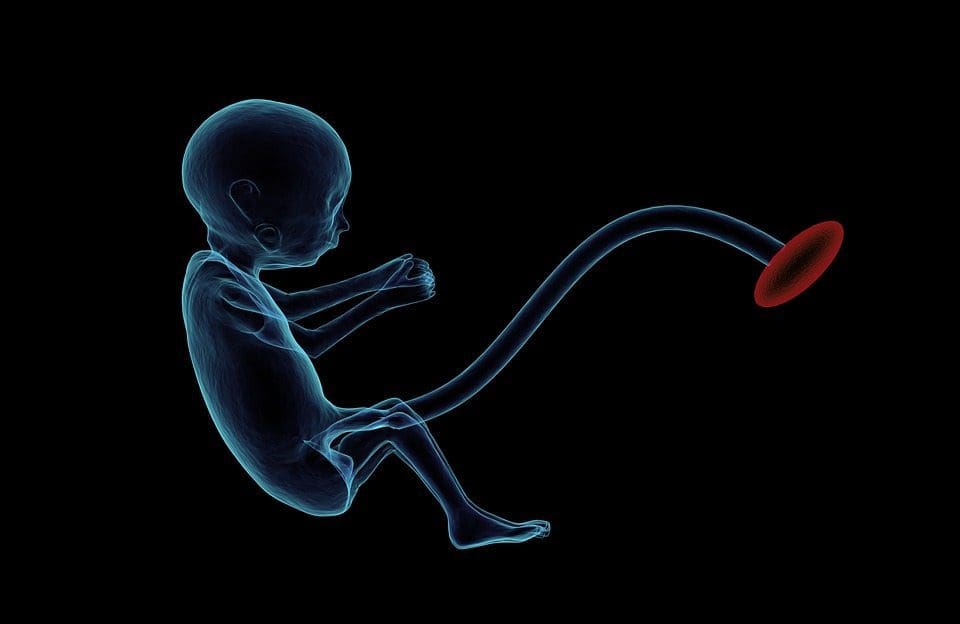 Prenatale omgeving: Twee recent gepubliceerde onderzoeken maakten gebruik van menselijke populaties die 'natuurlijke' variaties in de toevoer van voedingsstoffen ervoeren om de impact van maternale voeding voor of tijdens de zwangerschap op DNA-methylatie bij het nageslacht te bestuderen [68, 69]. De eerste studie gebruikte een Gambiaans moeder-kindcohort om aan te tonen dat zowel seizoensvariaties in de inname van methyldonor door de moeder tijdens de zwangerschap als de BMI van vóór de zwangerschap door de moeder geassocieerd waren met veranderde methylering bij de zuigelingen [69]. De tweede studie gebruikte volwassen nakomelingen van het Nederlandse Hongerwinter-cohort om het effect te onderzoeken van prenatale blootstelling aan een acute periode van ernstige maternale ondervoeding op DNA-methylatie van genen die betrokken zijn bij groei en metabolisme op volwassen leeftijd [68]. De resultaten benadrukten het belang van de timing van de blootstelling voor de impact ervan op het epigenoom, aangezien significante epigenetische effecten alleen werden geïdentificeerd bij personen die tijdens de vroege zwangerschap aan hongersnood waren blootgesteld. Belangrijk is dat de epigenetische veranderingen plaatsvonden in combinatie met een verhoogde BMI; het was echter niet mogelijk om in dit onderzoek vast te stellen of deze veranderingen eerder in het leven aanwezig waren of een gevolg waren van de hogere BMI.
Prenatale omgeving: Twee recent gepubliceerde onderzoeken maakten gebruik van menselijke populaties die 'natuurlijke' variaties in de toevoer van voedingsstoffen ervoeren om de impact van maternale voeding voor of tijdens de zwangerschap op DNA-methylatie bij het nageslacht te bestuderen [68, 69]. De eerste studie gebruikte een Gambiaans moeder-kindcohort om aan te tonen dat zowel seizoensvariaties in de inname van methyldonor door de moeder tijdens de zwangerschap als de BMI van vóór de zwangerschap door de moeder geassocieerd waren met veranderde methylering bij de zuigelingen [69]. De tweede studie gebruikte volwassen nakomelingen van het Nederlandse Hongerwinter-cohort om het effect te onderzoeken van prenatale blootstelling aan een acute periode van ernstige maternale ondervoeding op DNA-methylatie van genen die betrokken zijn bij groei en metabolisme op volwassen leeftijd [68]. De resultaten benadrukten het belang van de timing van de blootstelling voor de impact ervan op het epigenoom, aangezien significante epigenetische effecten alleen werden geïdentificeerd bij personen die tijdens de vroege zwangerschap aan hongersnood waren blootgesteld. Belangrijk is dat de epigenetische veranderingen plaatsvonden in combinatie met een verhoogde BMI; het was echter niet mogelijk om in dit onderzoek vast te stellen of deze veranderingen eerder in het leven aanwezig waren of een gevolg waren van de hogere BMI. Postnatale omgeving: Het epigenoom wordt de novo vastgesteld tijdens de embryonale ontwikkeling en daarom heeft de prenatale omgeving hoogstwaarschijnlijk de grootste invloed op het epigenoom. Het is nu echter duidelijk dat er veranderingen optreden in het 'rijpe' epigenoom onder invloed van een reeks omstandigheden, waaronder veroudering, blootstelling aan toxines en veranderingen in het dieet. Veranderingen in DNA-methylering in talrijke genen in skeletspieren en PGC1A in vetweefsel zijn bijvoorbeeld aangetoond als reactie op een vetrijk dieet [75, 76]. Interventies om lichaamsvetmassa te verliezen zijn ook in verband gebracht met veranderingen in DNA-methylering. Studies hebben gemeld dat de DNA-methylatieprofielen van vetweefsel [43, 64], mononucleaire cellen uit perifeer bloed [77] en spierweefsel [78] bij voorheen zwaarlijvige patiënten meer lijken op de profielen van magere proefpersonen na gewichtsverlies. Gewichtsverlieschirurgie keerde ook gedeeltelijk niet-alcoholische leververvetting-geassocieerde methylatieveranderingen in de lever om [79] en leidde in een ander onderzoek tot hypomethylering van meerdere kandidaatgenen voor obesitas, met meer uitgesproken effecten in subcutaan vergeleken met omentaal (visceraal) vet [64] . Accumulerend bewijs suggereert dat inspanningsinterventies ook de DNA-methylatie kunnen beïnvloeden. De meeste van deze onderzoeken zijn uitgevoerd bij magere individuen [80-82], maar één inspanningsonderzoek bij zwaarlijvige T2DM-patiënten toonde ook veranderingen in DNA-methylatie aan, inclusief in genen die betrokken zijn bij vetzuur- en glucosetransport [83]. Epigenetische veranderingen treden ook op bij het ouder worden, en recente gegevens suggereren een rol van obesitas bij het vergroten ervan [9, 84, 85]. Obesitas versnelde de epigenetische leeftijd van leverweefsel, maar in tegenstelling tot de hierboven beschreven bevindingen was dit effect niet omkeerbaar na gewichtsverlies [84].
Postnatale omgeving: Het epigenoom wordt de novo vastgesteld tijdens de embryonale ontwikkeling en daarom heeft de prenatale omgeving hoogstwaarschijnlijk de grootste invloed op het epigenoom. Het is nu echter duidelijk dat er veranderingen optreden in het 'rijpe' epigenoom onder invloed van een reeks omstandigheden, waaronder veroudering, blootstelling aan toxines en veranderingen in het dieet. Veranderingen in DNA-methylering in talrijke genen in skeletspieren en PGC1A in vetweefsel zijn bijvoorbeeld aangetoond als reactie op een vetrijk dieet [75, 76]. Interventies om lichaamsvetmassa te verliezen zijn ook in verband gebracht met veranderingen in DNA-methylering. Studies hebben gemeld dat de DNA-methylatieprofielen van vetweefsel [43, 64], mononucleaire cellen uit perifeer bloed [77] en spierweefsel [78] bij voorheen zwaarlijvige patiënten meer lijken op de profielen van magere proefpersonen na gewichtsverlies. Gewichtsverlieschirurgie keerde ook gedeeltelijk niet-alcoholische leververvetting-geassocieerde methylatieveranderingen in de lever om [79] en leidde in een ander onderzoek tot hypomethylering van meerdere kandidaatgenen voor obesitas, met meer uitgesproken effecten in subcutaan vergeleken met omentaal (visceraal) vet [64] . Accumulerend bewijs suggereert dat inspanningsinterventies ook de DNA-methylatie kunnen beïnvloeden. De meeste van deze onderzoeken zijn uitgevoerd bij magere individuen [80-82], maar één inspanningsonderzoek bij zwaarlijvige T2DM-patiënten toonde ook veranderingen in DNA-methylatie aan, inclusief in genen die betrokken zijn bij vetzuur- en glucosetransport [83]. Epigenetische veranderingen treden ook op bij het ouder worden, en recente gegevens suggereren een rol van obesitas bij het vergroten ervan [9, 84, 85]. Obesitas versnelde de epigenetische leeftijd van leverweefsel, maar in tegenstelling tot de hierboven beschreven bevindingen was dit effect niet omkeerbaar na gewichtsverlies [84].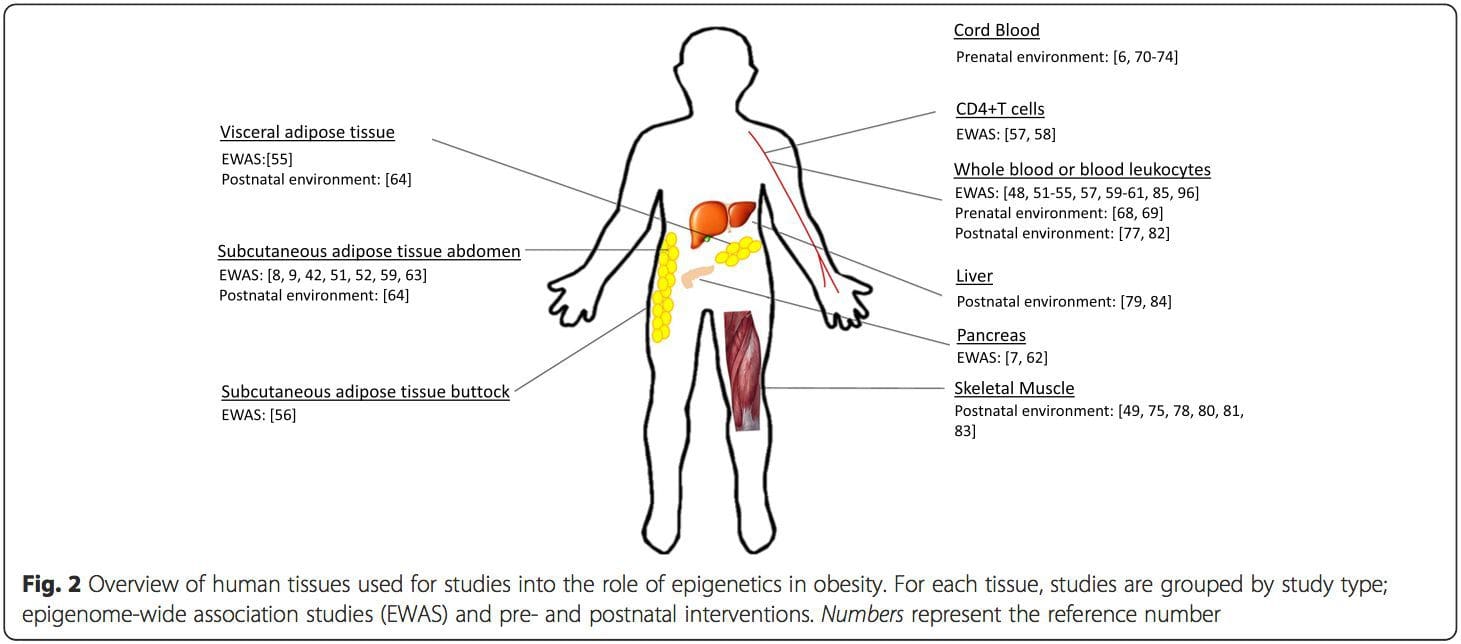 Conclusies
Conclusies



