Ketonlichamen worden aangemaakt door de lever en gebruikt als energiebron wanneer glucose niet direct beschikbaar is in het menselijk lichaam. De twee belangrijkste ketonlichamen zijn acetoacetaat (AcAc) en 3-beta-hydroxybutyraat (3HB), terwijl aceton het derde en minst voorkomende ketonlichaam is. Ketonen zijn altijd aanwezig in het bloed en hun niveaus stijgen tijdens vasten en langdurige inspanning.�ketogenese is het biochemische proces waarbij organismen ketonlichamen produceren door de afbraak van vetzuren en ketogene aminozuren.
Ketonlichamen worden voornamelijk gegenereerd in de mitochondriën van levercellen. Ketogenese treedt op wanneer er lage glucosespiegels in het bloed zijn, vooral nadat andere cellulaire koolhydraatvoorraden, zoals glycogeen, zijn uitgeput. Dit mechanisme kan ook optreden als er onvoldoende insuline is. De productie van ketonlichamen wordt uiteindelijk gestart om energie beschikbaar te maken die in het menselijk lichaam wordt opgeslagen als vetzuren. Ketogenese vindt plaats in de mitochondriën waar het onafhankelijk wordt gereguleerd.
Inhoud
Abstract
Het ketonlichaammetabolisme is een centraal knooppunt in fysiologische homeostase. In deze review bespreken we hoe ketonen een discrete fijnafstemming van metabolische rollen hebben die de prestaties van organen en organismen optimaliseren in verschillende nutriëntenresten en beschermen tegen ontstekingen en verwondingen in meerdere orgaansystemen. Traditioneel gezien als metabolische substraten die alleen worden gebruikt bij koolhydraatbeperking, onderstrepen recente waarnemingen het belang van ketonlichamen als vitale metabole en signaalmediatoren wanneer koolhydraten in overvloed aanwezig zijn. Als aanvulling op een repertoire van bekende therapeutische opties voor ziekten van het zenuwstelsel, zijn prospectieve rollen voor ketonlichamen bij kanker ontstaan, evenals intrigerende beschermende rollen in hart en lever, waardoor therapeutische opties ontstaan bij obesitas-gerelateerde en cardiovasculaire aandoeningen. Controverses in ketonmetabolisme en -signalering worden besproken om klassieke dogma's te verzoenen met hedendaagse observaties.
Introductie
Ketonlichamen zijn een essentiële alternatieve metabolische brandstofbron voor alle domeinen van het leven, eukarya, bacteriën en archaea (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). Het ketonlichaammetabolisme bij mensen is gebruikt om de hersenen van brandstof te voorzien tijdens episodische perioden van tekort aan voedingsstoffen. Ketonlichamen zijn verweven met cruciale metabole routes bij zoogdieren zoals ?-oxidatie (FAO), de tricarbonzuurcyclus (TCA), gluconeogenese, de novo lipogenese (DNL) en biosynthese van sterolen. Bij zoogdieren worden ketonlichamen voornamelijk in de lever geproduceerd uit FAO-afgeleid acetyl-CoA, en ze worden getransporteerd naar extrahepatische weefsels voor terminale oxidatie. Deze fysiologie biedt een alternatieve brandstof die wordt versterkt door relatief korte perioden van vasten, waardoor de beschikbaarheid van vetzuren toeneemt en de beschikbaarheid van koolhydraten afneemt (Cahill GF Jr, 2006; McGarry en Foster, 1980; Robinson en Williamson, 1980). De oxidatie van ketonen levert een belangrijke bijdrage aan het algehele energiemetabolisme van zoogdieren in extrahepatische weefsels in een groot aantal fysiologische toestanden, waaronder vasten, uithongering, de neonatale periode, na inspanning, zwangerschap en het volgen van koolhydraatarme diëten. De circulerende totale ketonlichaamconcentraties bij gezonde volwassen mensen vertonen normaal gesproken circadiane schommelingen tussen ongeveer 100-250 �M, stijgen tot ~1 mM na langdurige inspanning of 24 uur vasten, en kunnen accumuleren tot wel 20 mM in pathologische toestanden zoals diabetische ketoacidose ( Cahill GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson en Williamson, 1980; Wildenhoff et al., 1974). De menselijke lever produceert tot 300 g ketonlichamen per dag (Balasse en Fery, 1989), die tussen de 5% van het totale energieverbruik bijdragen in gevoede, nuchtere en uitgehongerde toestanden (Balasse et al., 20; Cox et al. al., 1978).
Recente studies benadrukken nu de dwingende rol voor ketonlichamen in het celmetabolisme, homeostase en signalering van zoogdieren onder een grote verscheidenheid aan fysiologische en pathologische toestanden. Afgezien van het dienen als energiebrandstof voor extrahepatische weefsels zoals hersenen, hart of skeletspieren, spelen ketonlichamen een cruciale rol als signaalbemiddelaars, aanjagers van post-translationele eiwitmodificatie (PTM) en modulatoren van ontsteking en oxidatieve stress. In deze review bieden we zowel klassieke als moderne opvattingen over de pleiotrope rollen van ketonlichamen en hun metabolisme.
Overzicht van ketonlichaammetabolisme
De snelheid van hepatische ketogenese wordt bepaald door een georkestreerde reeks fysiologische en biochemische transformaties van vet. Primaire regulatoren omvatten lipolyse van vetzuren uit triacylglycerolen, transport naar en door het hepatocytplasmamembraan, transport naar mitochondriën via carnitinepalmitoyltransferase 1 (CPT1), de ?-oxidatiespiraal, TCA-cyclusactiviteit en tussenliggende concentraties, redoxpotentiaal en de hormonale regulatoren van deze processen, voornamelijk glucagon en insuline [besproken in (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry en Foster , 1980; Williamson et al., 1969)]. Klassiek wordt ketogenese gezien als een overlooproute, waarbij van ?-oxidatie afgeleid acetyl-CoA de citraatsynthaseactiviteit en/of de beschikbaarheid van oxaalacetaat voor condensatie om citraat te vormen, overschrijdt. Tussenproducten met drie koolstofatomen vertonen anti-ketogene activiteit, vermoedelijk vanwege hun vermogen om de oxaalacetaatvoorraad voor acetyl-CoA-consumptie uit te breiden, maar de acetyl-CoA-concentratie in de lever alleen bepaalt niet de ketogene snelheid (Foster, 1967; Rawat en Menahan, 1975; Williamson et al., 1969). De regulatie van ketogenese door hormonale, transcriptionele en post-translationele gebeurtenissen ondersteunen samen het idee dat de moleculaire mechanismen die de ketogene snelheid verfijnen, onvolledig worden begrepen (zie Regulatie van HMGCS2 en SCOT/OXCT1).
Ketogenese vindt voornamelijk plaats in de mitochondriale matrix van de lever met snelheden die evenredig zijn met de totale vetoxidatie. Na transport van acylketens over de mitochondriale membranen en ?-oxidatie, katalyseert de mitochondriale isovorm van 3-hydroxymethylglutaryl-CoA-synthase (HMGCS2) het lot waarbij condensatie van acetoacetyl-CoA (AcAc-CoA) en acetyl-CoA wordt bewerkstelligd om HMG-CoA te genereren (Fig. 1A). HMG-CoA-lyase (HMGCL) splitst HMG-CoA om acetyl-CoA en acetoacetaat (AcAc) vrij te maken, en de laatste wordt gereduceerd tot d-?-hydroxybutyraat (d-?OHB) door fosfatidylcholine-afhankelijke mitochondriale d-?OHB-dehydrogenase ( BDH1) in een NAD+/NADH-gekoppelde bijna-evenwichtsreactie (Bock en Fleischer, 1975; LEHNINGER et al., 1960). De BDH1-evenwichtsconstante bevordert de d-?OHB-productie, maar de verhouding van AcAc/d-?OHB-ketonlichamen is recht evenredig met de mitochondriale NAD+/NADH-verhouding, en dus moduleert BDH1-oxidoreductase-activiteit de mitochondriale redoxpotentiaal (Krebs et al., 1969; Williamson et al., 1967). AcAc kan ook spontaan decarboxyleren tot aceton (Pedersen, 1929), de bron van zoete geur bij mensen die lijden aan ketoacidose (dwz totale serumketonlichamen > ~7 mM; AcAc pKa 3.6, ?OHB pKa 4.7). De mechanismen waardoor ketonlichamen door het mitochondriale binnenmembraan worden getransporteerd, zijn niet bekend, maar AcAc/d-?OHB worden door cellen vrijgemaakt via monocarboxylaattransporters (bij zoogdieren, MCT 1 en 2, ook bekend als opgeloste stofdrager 16A-familieleden 1 en 7) en in de bloedsomloop getransporteerd naar extrahepatische weefsels voor terminale oxidatie (Cotter et al., 2011; Halestrap en Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Concentraties van circulerende ketonlichamen zijn hoger dan die in de extrahepatische weefsels (Harrison en Long, 1940), wat aangeeft dat ketonlichamen langs een concentratiegradiënt worden getransporteerd. Verlies van functie-mutaties in MCT1 zijn geassocieerd met spontane aanvallen van ketoacidose, wat een cruciale rol suggereert bij de import van ketonlichamen.
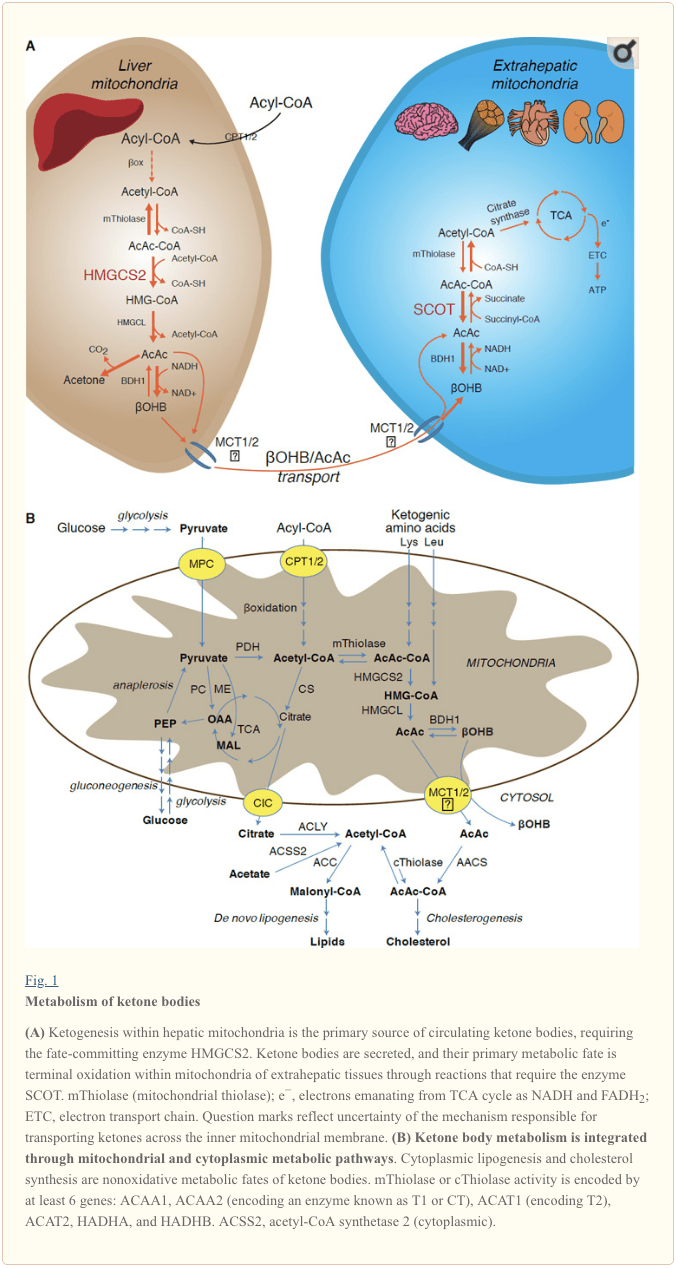
Met uitzondering van mogelijke omleiding van ketonlichamen naar niet-oxidatieve lotsbestemmingen (zie Niet-oxidatieve metabolische lotgevallen van ketonlichamen), hebben hepatocyten niet het vermogen om de ketonlichamen die ze produceren te metaboliseren. Ketonlichamen die de novo door de lever worden gesynthetiseerd, worden (i) in mitochondriën van extrahepatische weefsels gekataboliseerd tot acetyl-CoA, dat beschikbaar is voor de TCA-cyclus voor terminale oxidatie (Fig. 1A), (ii) omgeleid naar de lipogenese- of sterolsyntheseroutes ( Fig. 1B), of (iii) uitgescheiden in de urine. Als alternatieve energetische brandstof worden ketonlichamen gretig geoxideerd in hart, skeletspieren en hersenen (Balasse en Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan, 1988 ). Extrahepatische mitochondriale BDH1 katalyseert de eerste reactie van ?OHB-oxidatie en zet deze om in AcAc (LEHNINGER et al., 1960; Sandermann et al., 1986). Een cytoplasmatisch d-?OHB-dehydrogenase (BDH2) met slechts 20% sequentie-identiteit met BDH1 heeft een hoge Km voor ketonlichamen en speelt ook een rol bij de ijzerhomeostase (Davuluri et al., 2016; Guo et al., 2006) . In extrahepatische mitochondriale matrix wordt AcAc geactiveerd tot AcAc-CoA door uitwisseling van een CoA-deel van succinyl-CoA in een reactie die wordt gekatalyseerd door een uniek zoogdier-CoA-transferase, succinyl-CoA:3-oxoacid-CoA-transferase (SCOT, CoA-transferase; gecodeerd door OXCT1), via een bijna-evenwichtsreactie. De vrije energie die vrijkomt door hydrolyse van AcAc-CoA is groter dan die van succinyl-CoA, wat de vorming van AcAc bevordert. Dus de oxidatieve flux van het ketonlichaam treedt op als gevolg van massale actie: een overvloedige toevoer van AcAc en snelle consumptie van acetyl-CoA via citraatsynthase bevordert AcAc-CoA (+ succinaat) vorming door SCOT. Met name, in tegenstelling tot glucose (hexokinase) en vetzuren (acyl-CoA-synthetasen), vereist de activering van ketonlichamen (SCOT) in een oxideerbare vorm geen investering van ATP. Een omkeerbare AcAc-CoA-thiolasereactie [gekatalyseerd door een van de vier mitochondriale thiolasen die worden gecodeerd door ACAA2 (codering van een enzym dat bekend staat als T1 of CT), ACAT1 (codering van T2), HADHA of HADHB] levert twee moleculen acetyl-CoA op, die de TCA-cyclus binnengaan (Hersh en Jencks, 1967; Stern et al., 1956; Williamson et al., 1971). Tijdens ketotische toestanden (dwz totale serumketonen > 500 �M), leveren ketonlichamen een belangrijke bijdrage aan het energieverbruik en worden ze snel in weefsels gebruikt totdat de oxidatie wordt opgenomen of verzadigt (Balasse et al., 1978; Balasse en Fery, 1989 Edmond et al., 1987). Een zeer klein deel van de van de lever afgeleide ketonlichamen kan gemakkelijk in de urine worden gemeten, en het gebruik en de reabsorptie door de nieren zijn evenredig met de circulerende concentratie (Goldstein, 1987; Robinson en Williamson, 1980). Tijdens zeer ketotische toestanden (> 1 mM in plasma) dient ketonurie als een semi-kwantitatieve reporter van ketose, hoewel de meeste klinische tests van ketonlichamen in de urine AcAc detecteren maar niet ?OHB (Klocker et al., 2013).
Ketogene substraten en hun impact op het hepatocytmetabolisme
Ketogene substraten omvatten vetzuren en aminozuren (Fig. 1B). Het katabolisme van aminozuren, in het bijzonder leucine, genereert ongeveer 4% van de ketonlichamen in post-absorptieve toestand (Thomas et al., 1982). Dus de acetyl-CoA-substraatpool om ketonlichamen te genereren, is voornamelijk afkomstig van vetzuren, omdat pyruvaat tijdens toestanden van verminderde koolhydraattoevoer de hepatische TCA-cyclus voornamelijk binnenkomt via anaplerose, dwz ATP-afhankelijke carboxylatie tot oxaalacetaat (OAA), of tot malaat (MAL), en niet oxidatieve decarboxylatie tot acetyl-CoA (Jeoung et al., 2012; Magnusson et al., 1991; Merritt et al., 2011). In de lever dragen glucose en pyruvaat verwaarloosbaar bij aan ketogenese, zelfs wanneer de decarboxylatie van pyruvaat tot acetyl-CoA maximaal is (Jeoung et al., 2012).
Acetyl-CoA vervult verschillende rollen die integraal deel uitmaken van het intermediaire metabolisme in de lever voorbij ATP-generatie via terminale oxidatie (zie ook De integratie van ketonlichaammetabolisme, post-translationele modificatie en celfysiologie). Acetyl-CoA activeert allosterisch (i) pyruvaatcarboxylase (PC), waardoor een metabool controlemechanisme wordt geactiveerd dat de anaplerotische toegang van metabolieten in de TCA-cyclus verhoogt (Owen et al., 2002; Scrutton en Utter, 1967) en (ii) pyruvaatdehydrogenase kinase, dat pyruvaatdehydrogenase (PDH) fosforyleert en remt (Cooper et al., 1975), waardoor de stroom van pyruvaat in de TCA-cyclus via anaplerose verder wordt verbeterd. Bovendien remt cytoplasmatisch acetyl-CoA, waarvan de pool wordt aangevuld met mechanismen die mitochondriaal acetyl-CoA omzetten in transporteerbare metabolieten, de oxidatie van vetzuren: acetyl-CoA-carboxylase (ACC) katalyseert de omzetting van acetyl-CoA in malonyl-CoA, het lipogene substraat en allosterische remmer van mitochondriaal CPT1 [besproken in (Kahn et al., 2005; McGarry en Foster, 1980)]. Dus de mitochondriale acetyl-CoA-pool reguleert en wordt gereguleerd door de overlooproute van ketogenese, die de belangrijkste aspecten van het intermediaire levermetabolisme orkestreert.
Niet-oxidatief metabolisch lot van ketonlichamen
Het overheersende lot van van de lever afgeleide ketonen is SCOT-afhankelijke extrahepatische oxidatie. AcAc kan echter worden geëxporteerd vanuit mitochondriën en worden gebruikt in anabole routes via conversie naar AcAc-CoA door een ATP-afhankelijke reactie die wordt gekatalyseerd door cytoplasmatische acetoacetyl-CoA-synthetase (AACS, figuur 1B). Deze route is actief tijdens de ontwikkeling van de hersenen en in de melkgevende borstklier (Morris, 2005; Robinson en Williamson, 1978; Ohgami et al., 2003). AACS wordt ook sterk tot expressie gebracht in vetweefsel en geactiveerde osteoclasten (Aguilo et al., 2010; Yamasaki et al., 2016). Cytoplasmatisch AcAc-CoA kan ofwel door cytosolisch HMGCS1 worden gericht op de biosynthese van sterol, of door een van de twee cytoplasmatische thiolasen worden gesplitst tot acetyl-CoA (ACAA1 en ACAT2), gecarboxyleerd tot malonyl-CoA, en bijdragen aan de synthese van vetzuren (Bergstrom et al. al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber en Edmond, 1977).
Hoewel de fysiologische betekenis nog moet worden vastgesteld, kunnen ketonen zelfs in de lever als anabole substraten dienen. In kunstmatige experimentele contexten kan AcAc bijdragen tot wel de helft van het nieuw gesynthetiseerde lipide en tot 75% van het nieuwe gesynthetiseerde cholesterol (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). Omdat AcAc is afgeleid van onvolledige hepatische vetoxidatie, zou het vermogen van AcAc om bij te dragen aan lipogenese in vivo een futiele hepatische cyclus impliceren, waarbij van vet afgeleide ketonen kunnen worden gebruikt voor de productie van lipiden, een begrip waarvan de fysiologische betekenis experimentele validatie vereist, maar zou kunnen dienen adaptieve of onaangepaste rollen (Solinas et al., 2015). AcAc levert gretig cholesterogenese, met een lage AACS Km-AcAc (~ 50 �M) die AcAc-activering bevordert, zelfs in gevoede toestand (Bergstrom et al., 1984). De dynamische rol van cytoplasmatisch ketonmetabolisme is gesuggereerd in primaire embryonale neuronen van muizen en in van 3T3-L1 afgeleide adipocyten, aangezien AACS-knockdown de differentiatie van elk celtype verslechterde (Hasegawa et al., 2012a; Hasegawa et al., 2012b). Knockdown van AACS bij muizen in vivo verlaagde serumcholesterol (Hasegawa et al., 2012c). SREBP-2, een meestertranscriptieregulator van cholesterolbiosynthese, en peroxisoom proliferator geactiveerde receptor (PPAR)-? zijn AACS-transcriptieactivators en reguleren de transcriptie ervan tijdens de ontwikkeling van neurieten en in de lever (Aguilo et al., 2010; Hasegawa et al., 2012c). Alles bij elkaar genomen kan het metabolisme van het cytoplasmatische ketonlichaam belangrijk zijn bij bepaalde aandoeningen of natuurlijke ziektegeschiedenissen, maar het is niet toereikend om van de lever afgeleide ketonlichamen af te voeren, aangezien massale hyperketoniemie optreedt in de setting van selectieve verslechtering van het primaire oxidatieve lot via verlies van functiemutaties naar SCOT (Berry et al., 2001; Cotter et al., 2011).
Regulering van HMGCS2 en SCOT/OXCT1
De divergentie van een mitochondriaal van het gen dat codeert voor cytosolische HMGCS vond plaats vroeg in de evolutie van gewervelde dieren vanwege de noodzaak om hepatische ketogenese te ondersteunen bij soorten met hogere verhoudingen tussen hersenen en lichaamsgewicht (Boukaftane et al., 1994; Cunnane en Crawford, 2003). Natuurlijk voorkomende functieverlies HMGCS2-mutaties bij mensen veroorzaken aanvallen van hypoketotische hypoglykemie (Pitt et al., 2015; Thompson et al., 1997). Robuuste HMGCS2-expressie is beperkt tot hepatocyten en colonepitheel, en de expressie en enzymatische activiteit ervan worden gecoördineerd via diverse mechanismen (Mascaro et al., 1995; McGarry en Foster, 1980; Robinson en Williamson, 1980). Hoewel de volledige reikwijdte van fysiologische toestanden die HMGCS2 beïnvloeden verdere opheldering vereist, wordt de expressie en/of activiteit ervan gereguleerd tijdens de vroege postnatale periode, veroudering, diabetes, uithongering of inname van ketogeen dieet (Balasse en Fery, 1989; Cahill GF Jr, 2006 ; Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). Bij de foetus correleert de methylering van het 5�-flankerende gebied van het Hmgcs2-gen omgekeerd met de transcriptie ervan en wordt na de geboorte gedeeltelijk omgekeerd (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al. ., 1983). Evenzo vertoont hepatische Bdh1 een ontwikkelingsexpressiepatroon, dat toeneemt vanaf de geboorte tot het spenen, en wordt ook geïnduceerd door een ketogeen dieet op een fibroblastgroeifactor (FGF)-21-afhankelijke manier (Badman et al., 2007; Zhang et al., 1989 ). Ketogenese bij zoogdieren reageert zeer goed op zowel insuline als glucagon, en wordt respectievelijk onderdrukt en gestimuleerd (McGarry en Foster, 1977). Insuline onderdrukt de lipolyse van vetweefsel, waardoor de ketogenese van zijn substraat wordt beroofd, terwijl glucagon de ketogene flux verhoogt door een direct effect op de lever (Hegardt, 1999). Hmgcs2-transcriptie wordt gestimuleerd door forkhead-transcriptiefactor FOXA2, die wordt geremd via insuline-fosfatidylinositol-3-kinase/Akt, en wordt geïnduceerd door glucagon-cAMP-p300-signalering (Arias et al., 1995; Hegardt, 1999; Quant et al. , 1990; Thumelin et al., 1993; von Meyenn et al., 2013; Wolfrum et al., 2004; Wolfrum et al., 2003). PPAR? (Rodriguez et al., 1994) samen met zijn doelwit, FGF21 (Badman et al., 2007) induceren ook Hmgcs2-transcriptie in de lever tijdens uithongering of toediening van een ketogeen dieet (Badman et al., 2007; Inagaki et al., 2007 ). Inductie van PPAR? kan optreden vóór de overgang van foetale naar neonatale fysiologie, terwijl FGF21-activering in de vroege neonatale periode kan worden bevorderd via ?OHB-gemedieerde remming van histondeacetylase (HDAC)-3 (Rando et al., 2016). mTORC1 (zoogdierdoelwit van rapamycinecomplex 1) afhankelijke remming van PPAR? transcriptionele activiteit is ook een belangrijke regulator van Hmgcs2-genexpressie (Sengupta et al., 2010), en lever PER2, een meester-circadiane oscillator, reguleert indirect de Hmgcs2-expressie (Chavan et al., 2016). Recente waarnemingen geven aan dat extrahepatische tumor-geïnduceerde interleukine-6 ketogenese via PPAR? onderdrukking (Flint et al., 2016).
HMGCS2-enzymactiviteit wordt gereguleerd door meerdere PTM's. HMGCS2-serinefosforylering verhoogde de activiteit ervan in vitro (Grimsrud et al., 2012). HMGCS2-activiteit wordt allosterisch geremd door succinyl-CoA en lysineresidusuccinylatie (Arias et al., 1995; Hegardt, 1999; Lowe en Tubbs, 1985; Quant et al., 1990; Rardin et al., 2013; Reed et al., 1975; Thumelin et al., 1993). Succinylering van HMGCS2-, HMGCL- en BDH1-lysineresiduen in levermitochondriën zijn doelwitten van het NAD+-afhankelijke deacylase sirtuin 5 (SIRT5) (Rardin et al., 2013). HMGCS2-activiteit wordt ook versterkt door SIRT3-lysinedeacetylering, en het is mogelijk dat overspraak tussen acetylering en succinylering de HMGCS2-activiteit reguleert (Rardin et al., 2013; Shimazu et al., 2013). Ondanks het vermogen van deze PTM's om HMGCS2 Km en Vmax te reguleren, zijn fluctuaties van deze PTM's nog niet zorgvuldig in kaart gebracht en zijn ze niet bevestigd als mechanistische aanjagers van ketogenese in vivo.
SCOT komt tot expressie in alle zoogdiercellen die mitochondriën herbergen, behalve die van hepatocyten. Het belang van SCOT-activiteit en ketolyse werd aangetoond in SCOT-KO-muizen, die binnen 48 uur na de geboorte uniforme letaliteit vertoonden als gevolg van hyperketonemische hypoglykemie (Cotter et al., 2011). Weefselspecifiek verlies van SCOT in neuronen of skeletmyocyten veroorzaakt metabole afwijkingen tijdens uithongering, maar is niet dodelijk (Cotter et al., 2013b). Bij mensen manifesteert SCOT-deficiëntie zich vroeg in het leven met ernstige ketoacidose, die lethargie, braken en coma veroorzaakt (Berry et al., 2001; Fukao et al., 2000; Kassovska-Bratinova et al., 1996; Niezen-Koning et al. , 1997; Saudubray et al., 1987; Snyderman et al., 1998; Tildon en Cornblath, 1972). Op cellulair niveau is relatief weinig bekend over SCOT-gen- en eiwitexpressieregulatoren. Oxct1-mRNA-expressie en SCOT-eiwit en -activiteit zijn verminderd in ketotische toestanden, mogelijk door PPAR-afhankelijke mechanismen (Fenselau en Wallis, 1974; Fenselau en Wallis, 1976; Grinblat et al., 1986; Okuda et al., 1991; Turko et al. ., 2001; Wentz et al., 2010). Bij diabetische ketoacidose wordt de mismatch tussen hepatische ketogenese en extrahepatische oxidatie verergerd door een verslechtering van de SCOT-activiteit. Overexpressie van insuline-onafhankelijke glucosetransporter (GLUT1/SLC2A1) in cardiomyocyten remt ook de Oxct1-genexpressie en reguleert de terminale oxidatie van ketonen in een niet-ketotische toestand (Yan et al., 2009). In de lever wordt de overvloed aan Oxct1-mRNA onderdrukt door microRNA-122 en histonmethylering H3K27me3 die duidelijk zijn tijdens de overgang van de foetale naar de neonatale periode (Thorrez et al., 2011). De onderdrukking van Oxct1-expressie in de postnatale periode is echter voornamelijk toe te schrijven aan de evacuatie van hematopoëtische voorlopers die Oxct1 tot expressie brengen uit de lever, in plaats van een verlies van eerder bestaande Oxct1-expressie in terminaal gedifferentieerde hepatocyten. In feite is de expressie van Oxct1-mRNA en SCOT-eiwit in gedifferentieerde hepatocyten extreem laag (Orii et al., 2008).
SCOT wordt ook gereguleerd door PTM's. Het enzym is hypergeacetyleerd in de hersenen van SIRT3 KO-muizen, die ook een verminderde AcAc-afhankelijke acetyl-CoA-productie vertonen (Dittenhafer-Reed et al., 2015). Niet-enzymatische nitrering van tyrosineresiduen van SCOT verzwakt ook de activiteit ervan, wat is gemeld in de harten van verschillende diabetische muizenmodellen (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). Daarentegen verhoogt nitratie van tryptofaanresidu de SCOT-activiteit (Br�g�re et al., 2010; Rebrin et al., 2007). Moleculaire mechanismen van residu-specifieke nitrering of de-nitratie die zijn ontworpen om SCOT-activiteit te moduleren, kunnen bestaan en moeten worden opgehelderd.
Controverses in extrahepatische ketogenese
Bij zoogdieren is het primaire ketogene orgaan de lever, en alleen hepatocyten en darmepitheelcellen brengen de mitochondriale isovorm van HMGCS2 overvloedig tot expressie (Cotter et al., 2013a; Cotter et al., 2014; McGarry en Foster, 1980; Robinson en Williamson, 1980) . Anaërobe bacteriële fermentatie van complexe polysachariden levert butyraat op, dat wordt geabsorbeerd door colonocyten bij zoogdieren voor terminale oxidatie of ketogenese (Cherbuy et al., 1995), wat een rol kan spelen bij colonocytdifferentiatie (Wang et al., 2016). Met uitzondering van darmepitheelcellen en hepatocyten, is HMGCS2 bijna afwezig in bijna alle andere zoogdiercellen, maar het vooruitzicht van extrahepatische ketogenese is gerezen in tumorcellen, astrocyten van het centrale zenuwstelsel, de nier, pancreas? cellen, retinaal pigmentepitheel (RPE) en zelfs in skeletspieren (Adijanto et al., 2014; Avogaro et al., 1992; El Azzouny et al., 2016; Grabacka et al., 2016; Kang et al., 2015 ; Le Foll et al., 2014; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2016; Zhang et al., 2011). Ectopische HMGCS2 is waargenomen in weefsels die geen netto ketogeen vermogen hebben (Cook et al., 2016; Wentz et al., 2010), en HMGCS2 vertoont prospectieve ketogenese-onafhankelijke "moonlighting"-activiteiten, ook in de celkern (Chen et al. , 2016; Kostiuk et al., 2010; Meertens et al., 1998).
Elk extrahepatisch weefsel dat ketonlichamen oxideert, heeft ook het potentieel om ketonlichamen te accumuleren via HMGCS2-onafhankelijke mechanismen (Fig. 2A). Er is echter geen extrahepatisch weefsel waarin een stabiele ketonlichaamconcentratie hoger is dan die in de bloedsomloop (Cotter et al., 2011; Cotter et al., 2013b; Harrison en Long, 1940), wat erop wijst dat ketonlichamen naar beneden worden getransporteerd. concentratiegradiënt via MCT1/2-afhankelijke mechanismen. Een mechanisme van schijnbare extrahepatische ketogenese kan in feite de relatieve verslechtering van ketonoxidatie weerspiegelen. Aanvullende mogelijke verklaringen vallen binnen het domein van de vorming van ketonlichamen. Ten eerste kan de novo ketogenese plaatsvinden via omkeerbare enzymatische activiteit van thiolase en SCOT (Weidemann en Krebs, 1969). Wanneer de concentratie van acetyl-CoA relatief hoog is, verlopen de reacties die normaal verantwoordelijk zijn voor AcAc-oxidatie in de omgekeerde richting (GOLDMAN, 1954). Een tweede mechanisme treedt op wanneer van ?-oxidatie afgeleide tussenproducten accumuleren als gevolg van een TCA-cyclusknelpunt, AcAc-CoA wordt omgezet in l-?OHB-CoA via een reactie die wordt gekatalyseerd door mitochondriaal 3-hydroxyacyl-CoA-dehydrogenase, en verder door 3-hydroxybutyryl CoA-deacylase tot l-?OHB, dat door massaspectrometrie of resonantiespectroscopie niet te onderscheiden is van het fysiologische enantiomeer d-?OHB (Reed en Ozand, 1980). l-?OHB kan chromatografisch of enzymatisch worden onderscheiden van d-?OHB en is aanwezig in extrahepatische weefsels, maar niet in lever of bloed (Hsu et al., 2011). Hepatische ketogenese produceert alleen d-?OHB, het enige enantiomeer dat een BDH-substraat is (Ito et al., 1984; Lincoln et al., 1987; Reed en Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). Een derde HMGCS2-onafhankelijk mechanisme genereert d-?OHB via aminozuurkatabolisme, met name dat van leucine en lysine. Een vierde mechanisme is alleen duidelijk omdat het te wijten is aan een etiketteringsartefact en daarom pseudoketogenese wordt genoemd. Dit fenomeen is toe te schrijven aan de omkeerbaarheid van de SCOT- en thiolasereacties, en kan een overschatting van de ketonlichaamturnover veroorzaken als gevolg van de isotopische verdunning van ketonlichaamtracer in extrahepatisch weefsel (Des Rosiers et al., 1990; Fink et al., 1988) . Niettemin kan pseudoketogenese in de meeste contexten verwaarloosbaar zijn (Bailey et al., 1990; Keller et al., 1978). Een schema (Fig. 2A) geeft een bruikbare benadering aan om toe te passen, rekening houdend met verhoogde weefsel-steady-state-concentratie van ketonen.
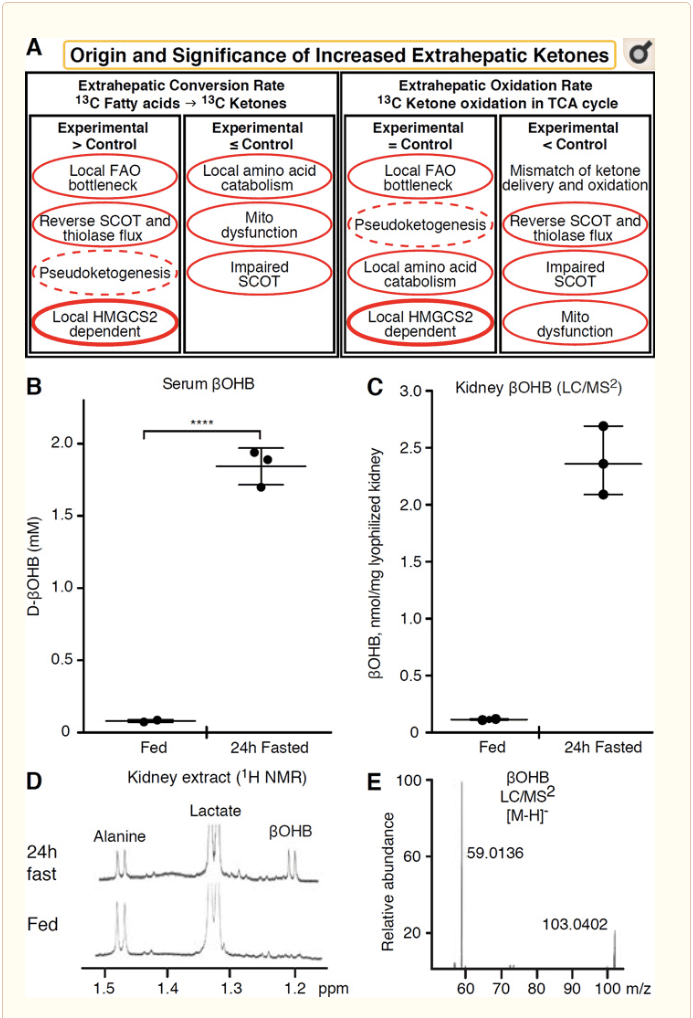

Nier heeft onlangs aandacht gekregen als een potentieel ketogeen orgaan. In de overgrote meerderheid van de staten is de nier een netto-verbruiker van uit de lever afgeleide ketonlichamen, die ketonlichamen uit de bloedbaan uitscheiden of opnieuw opnemen, en de nier is over het algemeen geen netto-ketonlichaamgenerator of -concentrator (Robinson en Williamson, 1980). De auteurs van een klassieke studie concludeerden dat minimale renale ketogenese, gekwantificeerd in een kunstmatig experimenteel systeem, fysiologisch niet relevant was (Weidemann en Krebs, 1969). Onlangs is renale ketogenese afgeleid in diabetische en autofagie-deficiënte muismodellen, maar het is waarschijnlijker dat verschuivingen van meerdere organen in metabole homeostase het integratieve ketonmetabolisme veranderen door input op meerdere organen (Takagi et al., 2016a; Takagi et al., 2016b; Zhang et al., 2011). Een recente publicatie suggereerde renale ketogenese als een beschermend mechanisme tegen ischemie-reperfusieschade in de nier (Tran et al., 2016). Absolute steady-state-concentraties van ?OHB uit extracten van nierweefsel van muizen werden gemeld bij ~4-12 mM. Om te testen of dit houdbaar was, hebben we ?OHB-concentraties gekwantificeerd in nierextracten van gevoede en 24 uur gevaste muizen. Serum ?OHB-concentraties stegen van ~ 100 �M tot 2 mM met 24 uur vasten (Fig. 2B), terwijl renale steady-state ?OHB-concentraties 100 M benaderen in gevoede toestand, en slechts 1 mM in 24 uur vasten (Fig. 2C�E), waarnemingen die consistent zijn met concentraties die meer dan 45 jaar geleden zijn gekwantificeerd (Hems en Brosnan, 1970). Het blijft mogelijk dat in ketotische toestanden van de lever afgeleide ketonlichamen renoprotectief kunnen zijn, maar het bewijs voor renale ketogenese vereist verdere onderbouwing. Overtuigend bewijs dat echte extrahepatische ketogenese ondersteunt, werd gepresenteerd in RPE (Adijanto et al., 2014). Er werd gesuggereerd dat deze intrigerende metabolische transformatie mogelijk van RPE afgeleide ketonen mogelijk zou maken om naar fotoreceptor- of Müller glia-cellen te stromen, wat zou kunnen helpen bij de regeneratie van het buitenste segment van de fotoreceptor.
?OHB als signaleringsbemiddelaar
Hoewel ze energetisch rijk zijn, oefenen ketonlichamen provocerende "niet-canonieke" signaalrollen uit in cellulaire homeostase (Fig. 3) (Newman en Verdin, 2014; Rojas-Morales et al., 2016). ?OHB remt bijvoorbeeld klasse I HDAC's, wat de histonacetylering verhoogt en daardoor de expressie induceert van genen die oxidatieve stress inperken (Shimazu et al., 2013). ?OHB zelf is een covalente histonmodificator van lysineresiduen in levers van nuchtere of door streptozotocine geïnduceerde diabetische muizen (Xie et al., 2016) (zie ook hieronder, De integratie van ketonlichaammetabolisme, post-translationele modificatie en celfysiologie, en ketonlichamen, oxidatieve stress en neuroprotectie).
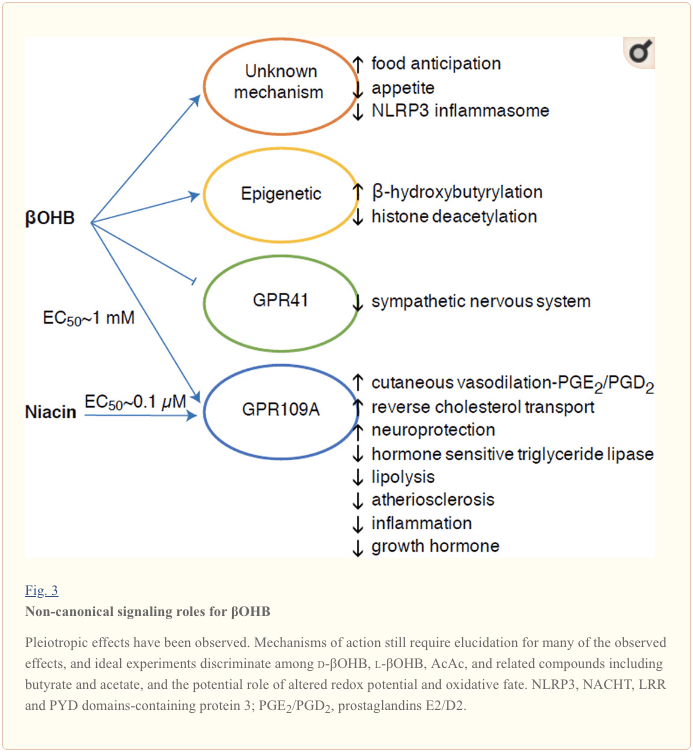
?OHB is ook een effector via G-eiwit gekoppelde receptoren. Door onduidelijke moleculaire mechanismen onderdrukt het de activiteit van het sympathische zenuwstelsel en vermindert het het totale energieverbruik en de hartslag door de korteketenvetzuursignalering via G-eiwitgekoppelde receptor 41 (GPR41) te remmen (Kimura et al., 2011). Een van de meest bestudeerde signaaleffecten van ?OHB verloopt via GPR109A (ook bekend als HCAR2), een lid van de hydrocarbonzuur GPCR-subfamilie die tot expressie wordt gebracht in vetweefsel (wit en bruin) (Tunaru et al., 2003), en in immuuncellen (Ahmed et al., 2009). ?OHB is het enige bekende endogene ligand van de GPR109A-receptor (EC50 ~770 �M) geactiveerd door d-?OHB, l-?OHB en butyraat, maar niet AcAc (Taggart et al., 2005). De hoge concentratiedrempel voor GPR109A-activering wordt bereikt door het volgen van een ketogeen dieet, uithongering of tijdens ketoacidose, wat leidt tot remming van de lipolyse van vetweefsel. Het anti-lipolytische effect van GPR109A verloopt door remming van adenylylcyclase en verlaagde cAMP, waardoor hormoongevoelige triglyceridelipase wordt geremd (Ahmed et al., 2009; Tunaru et al., 2003). Dit creëert een negatieve feedbacklus waarin ketose een modulerende rem op ketogenese zet door de afgifte van niet-veresterde vetzuren uit adipocyten te verminderen (Ahmed et al., 2009; Taggart et al., 2005), een effect dat kan worden gecompenseerd door de sympathische drive die lipolyse stimuleert. Niacine (vitamine B3, nicotinezuur) is een krachtige (EC50 ~ 0.1 �M) ligand voor GRP109A, die al tientallen jaren effectief wordt gebruikt voor dyslipidemieën (Benyo et al., 2005; Benyo et al., 2006; Fabbrini et al., 2010a; Lukasova et al., 2011; Tunaru et al., 2003). Terwijl niacine het omgekeerde cholesteroltransport in macrofagen verbetert en atherosclerotische laesies vermindert (Lukasova et al., 2011), blijven de effecten van ?OHB op atherosclerotische laesies onbekend. Hoewel de GPR109A-receptor een beschermende rol speelt en er intrigerende verbanden bestaan tussen het gebruik van ketogeen dieet bij beroerte en neurodegeneratieve ziekten (Fu et al., 2015; Rahman et al., 2014), is een beschermende rol van ?OHB via GPR109A niet in vivo aangetoond .
Ten slotte kan ?OHB de eetlust en verzadiging beïnvloeden. Een meta-analyse van onderzoeken die de effecten van ketogene en zeer energiezuinige diëten hebben gemeten, concludeerde dat deelnemers die deze diëten consumeerden een hogere verzadiging vertoonden in vergelijking met controlediëten (Gibson et al., 2015). Een plausibele verklaring voor dit effect zijn echter de extra metabole of hormonale elementen die de eetlust kunnen moduleren. Muizen die op een ketogeen dieet van knaagdieren werden gehouden, vertoonden bijvoorbeeld een verhoogd energieverbruik in vergelijking met muizen die met chow-controle werden gevoed, ondanks een vergelijkbare calorie-inname, en circulerend leptine of genen van peptiden die het voedingsgedrag reguleren, waren niet veranderd (Kennedy et al., 2007). Een van de voorgestelde mechanismen die de onderdrukking van eetlust door ?OHB suggereren, omvat zowel signalering als oxidatie (Laeger et al., 2010). Hepatocyt-specifieke deletie van het circadiane ritme-gen (Per2) en chromatine-immunoprecipitatie-onderzoeken onthulden dat PER2 het Cpt1a-gen direct activeert en indirect Hmgcs2 reguleert, wat leidt tot verminderde ketose bij Per2-knock-outmuizen (Chavan et al., 2016). Deze muizen vertoonden een verminderde anticipatie op voedsel, die gedeeltelijk werd hersteld door systemische toediening van ?OHB. Toekomstige studies zullen nodig zijn om te bevestigen dat het centrale zenuwstelsel een direct ?OHB-doelwit is, en of ketonoxidatie vereist is voor de waargenomen effecten, of dat er een ander signaalmechanisme bij betrokken is. Andere onderzoekers hebben de mogelijkheid ingeroepen van lokale door astrocyten afgeleide ketogenese in de ventromediale hypothalamus als een regulator van de voedselinname, maar deze voorlopige waarnemingen zullen ook profiteren van genetische en op flux gebaseerde beoordelingen (Le Foll et al., 2014). De relatie tussen ketose en tekort aan voedingsstoffen blijft van belang omdat honger en verzadiging belangrijke elementen zijn bij mislukte pogingen om gewicht te verliezen.
Integratie van ketonlichaammetabolisme, post-translationele modificatie en celfysiologie
Ketonlichamen dragen bij aan gecompartimentaliseerde pools van acetyl-CoA, een belangrijk tussenproduct dat een prominente rol speelt in het cellulaire metabolisme (Pietrocola et al., 2015). Een rol van acetyl-CoA is om te dienen als een substraat voor acetylering, een enzymatisch gekatalyseerde covalente histonmodificatie (Choudhary et al., 2014; Dutta et al., 2016; Fan et al., 2015; Menzies et al., 2016 ). Een groot aantal dynamisch geacetyleerde mitochondriale eiwitten, waarvan er vele kunnen voorkomen via niet-enzymatische mechanismen, zijn ook voortgekomen uit computationele proteomics-onderzoeken (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013 ; Shimazu et al., 2010). Lysine-deacetylasen gebruiken een zink-cofactor (bijv. nucleocytosolic HDAC's) of NAD+ als co-substraat (sirtuins, SIRT's) (Choudhary et al., 2014; Menzies et al., 2016). Het acetylproteoom dient als zowel sensor als effector van de totale cellulaire acetyl-CoA-pool, aangezien fysiologische en genetische manipulaties elk resulteren in niet-enzymatische globale variaties van acetylering (Weinert et al., 2014). Aangezien intracellulaire metabolieten dienen als modulatoren van acetylering van lysineresiduen, is het belangrijk om de rol van ketonlichamen te overwegen, waarvan de overvloed zeer dynamisch is.
?OHB is een epigenetische modifier via ten minste twee mechanismen. Verhoogde ?OHB-spiegels veroorzaakt door vasten, caloriebeperking, directe toediening of langdurige inspanning veroorzaken HDAC-remming of histonacetyltransferase-activering (Marosi et al., 2016; Sleiman et al., 2016) of tot oxidatieve stress (Shimazu et al., 2013) . ?OHB-remming van HDAC3 zou de metabole fysiologie van pasgeborenen kunnen reguleren (Rando et al., 2016). Onafhankelijk modificeert ?OHB zelf histonlysineresiduen direct (Xie et al., 2016). Langdurig vasten of door steptozotocine geïnduceerde diabetische ketoacidose verhoogde histon-?-hydroxybutyrylering. Hoewel het aantal lysine-a-hydroxybutyrylerings- en acetyleringsplaatsen vergelijkbaar was, werd stoichiometrisch grotere histon-a-hydroxybutyrylering dan acetylering waargenomen. Verschillende genen werden beïnvloed door histonlysine ?-hydroxybutyrylering, versus acetylering of methylering, wat verschillende cellulaire functies suggereert. Of ?-hydroxybutyrylering spontaan of enzymatisch is, is niet bekend, maar breidt het bereik van mechanismen uit via ketonlichamen die transcriptie dynamisch beïnvloeden.
Essentiële celherprogrammering tijdens caloriebeperking en nutriëntdeprivatie kan worden gemedieerd in respectievelijk SIRT3- en SIRT5-afhankelijke mitochondriale deacetylering en desuccinylering, die ketogene en ketolytische eiwitten reguleren op post-translationeel niveau in lever- en extrahepatische weefsels (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). Hoewel stoichiometrische vergelijking van bezette locaties niet noodzakelijk direct verband houdt met verschuivingen in metabole flux, is mitochondriale acetylering dynamisch en kan deze worden aangedreven door acetyl-CoA-concentratie of mitochondriale pH, in plaats van enzymatische acetyltransferasen (Wagner en Payne, 2013). Dat SIRT3 en SIRT5 de activiteiten van enzymen die het ketonlichaam metaboliseren moduleren, roept de vraag op naar de wederkerige rol van ketonen bij het vormen van het acetylproteoom, succinylproteoom en andere dynamische cellulaire doelen. Aangezien variaties van ketogenese NAD+-concentraties weerspiegelen, zouden de ketonproductie en overvloed de sirtuin-activiteit kunnen reguleren, waardoor de totale acetyl-CoA / succinyl-CoA-pools, het acylproteoom en dus de mitochondriale en celfysiologie worden beïnvloed. ?-hydroxybutyrylering van enzymlysineresiduen zou een nieuwe laag kunnen toevoegen aan cellulaire herprogrammering. In extrahepatische weefsels kan ketonlichaamoxidatie analoge veranderingen in celhomeostase stimuleren. Hoewel de compartimentering van acetyl-CoA-pools sterk gereguleerd is en een breed spectrum van cellulaire veranderingen coördineert, vereist het vermogen van ketonlichamen om zowel mitochondriale als cytoplasmatische acetyl-CoA-concentraties direct vorm te geven opheldering (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen en Thompson, 2012). Omdat acetyl-CoA-concentraties strak gereguleerd zijn en acetyl-CoA membraan-impermeabel is, is het van cruciaal belang om rekening te houden met de drijvende mechanismen die de homeostase van acetyl-CoA coördineren, inclusief de productiesnelheden en terminale oxidatie in de TCA-cyclus, omzetting in ketonlichamen, mitochondriale efflux via carnitine-acetyltransferase (CrAT), of acetyl-CoA-export naar cytosol na conversie naar citraat en afgifte door ATP-citraatlyase (ACLY). De sleutelrollen van deze laatste mechanismen in celacetylproteoom en homeostase vereisen een op elkaar afgestemd begrip van de rollen van ketogenese en ketonoxidatie (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen en Thompson, 2012). Convergente technologieën in metabolomics en acylproteomics in de setting van genetisch gemanipuleerde modellen zullen nodig zijn om doelen en resultaten te specificeren.
Anti- en pro-inflammatoire reacties op ketonlichamen
Ketose en ketonlichamen moduleren ontsteking en immuuncelfunctie, maar er zijn verschillende en zelfs tegenstrijdige mechanismen voorgesteld. Langdurig gebrek aan voedingsstoffen vermindert ontstekingen (Youm et al., 2015), maar de chronische ketose van diabetes type 1 is een pro-inflammatoire toestand (Jain et al., 2002; Kanikarla-Marie en Jain, 2015; Kurepa et al., 2012 ). Op mechanisme gebaseerde signaleringsrollen voor ?OHB bij ontstekingen komen naar voren omdat veel cellen van het immuunsysteem, waaronder macrofagen of monocyten, GPR109A overvloedig tot expressie brengen. Hoewel ?OHB een overwegend ontstekingsremmende reactie uitoefent (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), kunnen hoge concentraties ketonlichamen, met name AcAc, mogelijk een pro-inflammatoire respons veroorzaken (Jain et al., 2002; Kanikarla-Marie en Jain, 2015; Kurepa et al., 2012).
Ontstekingsremmende rollen van GPR109A-liganden bij atherosclerose, obesitas, inflammatoire darmaandoeningen, neurologische aandoeningen en kanker zijn beoordeeld (Graff et al., 2016). GPR109A-expressie wordt verhoogd in RPE-cellen van diabetische modellen, menselijke diabetespatiënten (Gambhir et al., 2012) en in microglia tijdens neurodegeneratie (Fu et al., 2014). Ontstekingsremmende effecten van ?OHB worden versterkt door overexpressie van GPR109A in RPE-cellen en opgeheven door farmacologische remming of genetische knock-out van GPR109A (Gambhir et al., 2012). ?OHB en exogeen nicotinezuur (Taggart et al., 2005), beide verlenen ontstekingsremmende effecten in TNF? of LPS-geïnduceerde ontsteking door het verlagen van de niveaus van pro-inflammatoire eiwitten (iNOS, COX-2) of uitgescheiden cytokines (TNF?, IL-1?, IL-6, CCL2/MCP-1), gedeeltelijk door remming van NF -?B-translocatie (Fu et al., 2014; Gambhir et al., 2012). ?OHB vermindert ER-stress en het NLRP3-inflammasoom, waardoor de antioxidatieve stressrespons wordt geactiveerd (Bae et al., 2016; Youm et al., 2015). Bij neurodegeneratieve ontsteking omvat GPR109A-afhankelijke ?OHB-gemedieerde bescherming echter geen ontstekingsmediatoren zoals MAPK-routesignalering (bijv. ERK, JNK, p38) (Fu et al., 2014), maar vereist mogelijk COX-1-afhankelijke PGD2 productie (Rahman et al., 2014). Het is intrigerend dat macrofaag GPR109A nodig is om een neuroprotectief effect uit te oefenen in een ischemisch beroertemodel (Rahman et al., 2014), maar het vermogen van ?OHB om het NLRP3-inflammasoom in uit beenmerg afgeleide macrofagen te remmen is GPR109A-onafhankelijk (Youm et al., 2015). ., 2014). Hoewel de meeste onderzoeken ?OHB koppelen aan ontstekingsremmende effecten, kan ?OHB pro-inflammatoir zijn en markers van lipideperoxidatie in kalfhepatocyten verhogen (Shi et al., XNUMX). Anti- versus pro-inflammatoire effecten van ?OHB kunnen dus afhangen van celtype, ?OHB-concentratie, blootstellingsduur en de aan- of afwezigheid van co-modulatoren.
In tegenstelling tot ?OHB kan AcAc pro-inflammatoire signalering activeren. Verhoogd AcAc, vooral met een hoge glucoseconcentratie, intensiveert endotheelcelbeschadiging door een NADPH-oxidase / oxidatieve stress-afhankelijk mechanisme (Kanikarla-Marie en Jain, 2015). Hoge AcAc-concentraties in de navelstreng van diabetische moeders waren gecorreleerd met een hogere eiwitoxidatiesnelheid en MCP-1-concentratie (Kurepa et al., 2012). Hoge AcAc bij diabetespatiënten was gecorreleerd met TNF? expressie (Jain et al., 2002), en AcAc, maar niet ?OHB, induceerde TNF?, MCP-1-expressie, ROS-accumulatie en verminderd cAMP-niveau in U937 menselijke monocytcellen (Jain et al., 2002; Kurepa et al. ., 2012).
Ketonlichaamafhankelijke signaleringsverschijnselen worden vaak alleen geactiveerd bij hoge ketonlichaamconcentraties (> 5 mM), en in het geval van veel onderzoeken die ketonen koppelen aan pro- of ontstekingsremmende effecten, door onduidelijke mechanismen. Vanwege de tegenstrijdige effecten van ?OHB versus AcAc op ontstekingen en het vermogen van de AcAc/?OHB-verhouding om het mitochondriale redoxpotentieel te beïnvloeden, vergelijken de beste experimenten die de rol van ketonlichamen op cellulaire fenotypen beoordelen bovendien de effecten van AcAc en ? OHB in verschillende verhoudingen en in verschillende cumulatieve concentraties [bijv. (Saito et al., 2016)]. Ten slotte kan AcAc alleen in de handel worden gekocht als een lithiumzout of als een ethylester die vóór gebruik basehydrolyse vereist. Lithiumkation induceert onafhankelijk signaaltransductiecascades (Manji et al., 1995), en AcAc-anion is labiel. Ten slotte kunnen studies met racemisch d/l-?OHB verwarrend zijn, aangezien alleen het d-?OHB-stereo-isomeer kan worden geoxideerd tot AcAc, maar d-?OHB en l-?OHB kunnen elk signaal via GPR109A, het NLRP3-inflammasoom remmen, en dienen als lipogene substraten.
Ketonlichamen, oxidatieve stress en neuroprotectie
Oxidatieve stress wordt typisch gedefinieerd als een toestand waarin ROS in overmaat wordt gepresenteerd, als gevolg van overmatige productie en/of verminderde eliminatie. Antioxidant en oxidatieve stressverlagende rollen van ketonlichamen zijn zowel in vitro als in vivo uitgebreid beschreven, met name in de context van neuroprotectie. Aangezien de meeste neuronen niet effectief hoogenergetische fosfaten uit vetzuren genereren, maar ketonlichamen oxideren wanneer er een tekort aan koolhydraten is, zijn neuroprotectieve effecten van ketonlichamen bijzonder belangrijk (Cahill GF Jr, 2006; Edmond et al., 1987; Yang et al., 1987). In modellen voor oxidatieve stress suggereren BDH1-inductie en SCOT-onderdrukking dat het metabolisme van het ketonlichaam opnieuw kan worden geprogrammeerd om verschillende celsignalering, redoxpotentiaal of metabolische vereisten te ondersteunen (Nagao et al., 2016; Tieu et al., 2003).
Ketonlichamen verminderen de gradaties van cellulaire schade, verwonding, dood en lagere apoptose in neuronen en cardiomyocyten (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). Ingeroepen mechanismen zijn gevarieerd en niet altijd lineair gerelateerd aan concentratie. Lage millimolaire concentraties van (d of l)-?OHB vangen ROS (hydroxylanion), terwijl AcAc talrijke ROS-soorten opruimt, maar alleen bij concentraties die het fysiologische bereik overschrijden (IC50 20-67 mM) (Haces et al., 2008) . Omgekeerd is een gunstige invloed op de redoxpotentiaal van de elektronentransportketen een mechanisme dat gewoonlijk wordt gekoppeld aan d-?OHB. Terwijl alle drie de ketonlichamen (d/l-?OHB en AcAc) neuronale celdood en ROS-accumulatie veroorzaakten door chemische remming van glycolyse verminderden, voorkwamen alleen d-?OHB en AcAc neuronale ATP-afname. Omgekeerd, in een hypoglycemisch in vivo-model, verhinderde (d of l)-?OHB, maar niet AcAc, hippocampale lipideperoxidatie (Haces et al., 2008; Maalouf et al., 2007; Marosi et al., 2016; Murphy, 2009 ; Tieu et al., 2003). In vivo studies van muizen die een ketogeen dieet kregen (87% kcal vet en 13% eiwit) vertoonden neuroanatomische variatie in antioxidantcapaciteit (Ziegler et al., 2003), waarbij de meest ingrijpende veranderingen werden waargenomen in de hippocampus, met een toename van glutathionperoxidase en totaal antioxidant capaciteiten.
Ketogeen dieet, ketonesters (zie ook Therapeutisch gebruik van ketogeen dieet en exogene ketonlichamen), of toediening van ?OHB oefenen neuroprotectie uit in modellen van ischemische beroerte (Rahman et al., 2014); de ziekte van Parkinson (Tieu et al., 2003); zuurstofvergiftiging van het centrale zenuwstelsel (D'Agostino et al., 2013); epileptische spasmen (Yum et al., 2015); mitochondriale encefalomyopathie, lactaatacidose en beroerte-achtige (MELAS) episodes-syndroom (Frey et al., 2016) en de ziekte van Alzheimer (Cunnane en Crawford, 2003; Yin et al., 2016). Omgekeerd toonde een recent rapport histopathologisch bewijs aan van neurodegeneratieve progressie door een ketogeen dieet in een transgeen muismodel van abnormaal mitochondriaal DNA-herstel, ondanks toename van mitochondriale biogenese en antioxidantsignaturen (Lauritzen et al., 2016). Andere tegenstrijdige rapporten suggereren dat blootstelling aan hoge ketonlichaamconcentraties oxidatieve stress veroorzaakt. Hoge ?OHB- of AcAc-doses induceerden stikstofmonoxide-secretie, lipideperoxidatie, verminderde expressie van SOD, glutathionperoxidase en katalase in hepatocyten van kalveren, terwijl in hepatocyten van ratten de MAPK-pathway-inductie werd toegeschreven aan AcAc maar niet aan ?OHB (Abdelmegeed et al., 2004 ; Shi et al., 2014; Shi et al., 2016).
Alles bij elkaar genomen, koppelen de meeste rapporten ?OHB aan de vermindering van oxidatieve stress, aangezien de toediening ervan de productie van ROS/superoxide remt, lipideperoxidatie en eiwitoxidatie voorkomt, de antioxidant-eiwitniveaus verhoogt en de mitochondriale ademhaling en ATP-productie verbetert (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie en Jain, 2015; Maalouf et al., 2007; Maalouf en Rho, 2008; Marosi et al., 2016; Tieu et al., 2003; Yin et al., 2016; Ziegler et al., 2003). Hoewel AcAc directer gecorreleerd is dan ?OHB met de inductie van oxidatieve stress, zijn deze effecten niet altijd gemakkelijk te onderscheiden van toekomstige pro-inflammatoire reacties (Jain et al., 2002; Kanikarla-Marie en Jain, 2015; Kanikarla-Marie en Jaïn, 2016). Bovendien is het van cruciaal belang om te bedenken dat het schijnbare antioxidatieve voordeel dat wordt verleend door pleiotrope ketogene diëten mogelijk niet wordt getransduceerd door ketonlichamen zelf, en dat neuroprotectie die wordt verleend door ketonlichamen mogelijk niet volledig te wijten is aan oxidatieve stress. Bijvoorbeeld tijdens glucosedeprivatie, in een model van glucosedeprivatie in corticale neuronen, stimuleerde ?OHB autofagische flux en verhinderde autofagosoomaccumulatie, wat geassocieerd was met verminderde neuronale dood (Camberos-Luna et al., 2016). d-?OHB induceert ook de canonieke antioxidant-eiwitten FOXO3a, SOD, MnSOD en catalase, prospectief door HDAC-remming (Nagao et al., 2016; Shimazu et al., 2013).
Niet-alcoholische leververvetting (NAFLD) en ketonenmetabolisme
Obesitas-geassocieerde NAFLD en niet-alcoholische steatohepatitis (NASH) zijn de meest voorkomende oorzaken van leverziekte in westerse landen (Rinella en Sanyal, 2016), en NASH-geïnduceerd leverfalen is een van de meest voorkomende redenen voor levertransplantatie. Hoewel overmatige opslag van triacylglycerolen in hepatocyten >5% van het levergewicht (NAFL) alleen geen degeneratieve leverfunctie veroorzaakt, correleert de progressie naar NAFLD bij mensen met systemische insulineresistentie en een verhoogd risico op type 2-diabetes, en kan het bijdragen aan de pathogenese van hart- en vaatziekten en chronische nierziekte (Fabbrini et al., 2009; Targher et al., 2010; Targher en Byrne, 2013). De pathogene mechanismen van NAFLD en NASH zijn niet volledig begrepen, maar omvatten afwijkingen van het hepatocytmetabolisme, hepatocyt-autofagie en endoplasmatisch reticulumstress, leverimmuuncelfunctie, vetweefselontsteking en systemische inflammatoire mediatoren (Fabbrini et al., 2009; Masuoka en Chalasani, 2013 ; Targher et al., 2010; Yang et al., 2010). Verstoringen van het koolhydraat-, lipide- en aminozuurmetabolisme komen voor in en dragen bij aan obesitas, diabetes en NAFLD bij mensen en in modelorganismen [besproken in (Farese et al., 2012; Lin en Accili, 2011; Newgard, 2012; Samuel en Shulman, 2012; Sun en Lazar, 2013)]. Hoewel hepatocytafwijkingen in het cytoplasmatisch lipidenmetabolisme vaak worden waargenomen in NAFLD (Fabbrini et al., 2010b), is de rol van het mitochondriale metabolisme, dat de oxidatieve verwijdering van vetten regelt, minder duidelijk in de pathogenese van NAFLD. Afwijkingen van het mitochondriaal metabolisme komen voor in en dragen bij aan de pathogenese van NAFLD/NASH (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). Er is algemeen (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) maar niet uniform ( Koliaki en Roden, 2013; Perry et al., 2016; Rector et al., 2010) consensus dat, voorafgaand aan de ontwikkeling van bonafide NASH, mitochondriale oxidatie in de lever, en in het bijzonder vetoxidatie, wordt vergroot in obesitas, systemische insulineresistentie en NAFLD. Het is waarschijnlijk dat naarmate NAFLD vordert, oxidatieve capaciteitsheterogeniteit, zelfs tussen individuele mitochondriën, naar voren komt, en uiteindelijk de oxidatieve functie wordt aangetast (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al., 2012; Satapati et al. ., XNUMX).
Ketogenese wordt vaak gebruikt als een proxy voor hepatische vetoxidatie. Verslechteringen van ketogenese komen naar voren naarmate NAFLD vordert in diermodellen, en waarschijnlijk bij mensen. Door onvolledig gedefinieerde mechanismen onderdrukt hyperinsulinemie ketogenese, wat mogelijk bijdraagt aan hypoketonemie in vergelijking met magere controles (Bergman et al., 2007; Bickerton et al., 2008; Satapati et al., 2012; Soeters et al., 2009; Sunny et al. , 2011; Vice et al., 2005). Desalniettemin is het vermogen van circulerende ketonlichaamconcentraties om NAFLD te voorspellen controversieel (Mnnist et al., 2015; Sanyal et al., 2001). Robuuste kwantitatieve magnetische resonantie spectroscopische methoden in diermodellen onthulden een verhoogde keton-turnoversnelheid met matige insulineresistentie, maar verminderde percentages waren duidelijk met ernstigere insulineresistentie (Satapati et al., 2012; Sunny et al., 2010). Bij zwaarlijvige mensen met leververvetting is de ketogene snelheid normaal (Bickerton et al., 2008; Sunny et al., 2011), en daarom neemt de snelheid van ketogenese af ten opzichte van de verhoogde vetzuurbelasting in hepatocyten. Bijgevolg kan van ?-oxidatie afgeleid acetyl-CoA worden gericht op terminale oxidatie in de TCA-cyclus, waardoor terminale oxidatie, door fosfoenolpyruvaat aangedreven gluconeogenese via anaplerose/cataplerose en oxidatieve stress wordt verhoogd. Acetyl-CoA wordt mogelijk ook geëxporteerd vanuit mitochondriën als citraat, een voorlopersubstraat voor lipogenese (Fig. 4) (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). Terwijl ketogenese minder snel reageert op insuline of vasten bij langdurige obesitas (Satapati et al., 2012), blijven de onderliggende mechanismen en stroomafwaartse gevolgen hiervan onvolledig begrepen. Recent bewijs geeft aan dat mTORC1 ketogenese onderdrukt op een manier die mogelijk stroomafwaarts is van insulinesignalering (Kucejova et al., 2016), wat in overeenstemming is met de waarnemingen dat mTORC1 PPAR?-gemedieerde Hmgcs2-inductie remt (Sengupta et al., 2010) ( zie ook Regeling van HMGCS2 en SCOT/OXCT1).

Voorlopige observaties van onze groep suggereren nadelige gevolgen voor de lever van ketogene insufficiëntie (Cotter et al., 2014). Om de hypothese te testen dat gestoorde ketogenese, zelfs in koolhydraatrijke en dus 'niet-ketogene' toestanden, bijdraagt aan een abnormaal glucosemetabolisme en steatohepatitis veroorzaakt, hebben we een muismodel met duidelijke ketogene insufficiëntie gegenereerd door toediening van antisense-oligonucleotiden (ASO) gericht op Hmgcs2. Verlies van HMGCS2 in standaard vetarme volwassen muizen veroorzaakte milde hyperglykemie en een duidelijk verhoogde productie van honderden levermetabolieten, waarvan een reeks sterk suggereerde activatie van lipogenese. Vetrijke voeding van muizen met onvoldoende ketogenese resulteerde in uitgebreide hepatocytbeschadiging en -ontsteking. Deze bevindingen ondersteunen de centrale hypothesen dat (i) ketogenese geen passieve overlooproute is, maar eerder een dynamisch knooppunt in hepatische en geïntegreerde fysiologische homeostase, en (ii) voorzichtige ketogene augmentatie om NAFLD/NASH en verstoord leverglucosemetabolisme te onderzoeken, is het waard om te worden onderzocht. .
Hoe kan een verminderde ketogenese bijdragen aan leverbeschadiging en veranderde glucosehomeostase? De eerste overweging is of de boosdoener een tekort aan ketogene flux is, of ketonen zelf. Een recent rapport suggereert dat ketonlichamen door oxidatieve stress veroorzaakte leverbeschadiging kunnen verminderen als reactie op n-3 meervoudig onverzadigde vetzuren (Pawlak et al., 2015). Bedenk dat vanwege een gebrek aan SCOT-expressie in hepatocyten, ketonlichamen niet worden geoxideerd, maar dat ze kunnen bijdragen aan lipogenese en een verscheidenheid aan signaleringsrollen kunnen vervullen, onafhankelijk van hun oxidatie (zie ook niet-oxidatieve metabolische lotgevallen van ketonlichamen en ?OHB als een signaalbemiddelaar). Het is ook mogelijk dat van hepatocyten afgeleide ketonlichamen kunnen dienen als signaal en/of metaboliet voor naburige celtypen in de leveracinus, waaronder stellaatcellen en Kupffer-celmacrofagen. Hoewel de beperkte beschikbare literatuur suggereert dat macrofagen niet in staat zijn ketonlichamen te oxideren, is dit alleen gemeten met behulp van klassieke methodologieën en alleen in peritoneale macrofagen (Newsholme et al., 1986; Newsholme et al., 1987), wat aangeeft dat een re- beoordeling is passend gezien de overvloedige SCOT-expressie in van beenmerg afgeleide macrofagen (Youm et al., 2015).
De ketogene flux van hepatocyten kan ook cytoprotectief zijn. Hoewel heilzame mechanismen mogelijk niet per se afhankelijk zijn van ketogenese, zijn ketogene diëten met weinig koolhydraten in verband gebracht met verbetering van NAFLD (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar en Crawford, 2012) . Onze waarnemingen geven aan dat ketogenese van hepatocyten feedback kan geven en de TCA-cyclusflux, anaplerotische flux, van fosfoenolpyruvaat afgeleide gluconeogenese (Cotter et al., 2014) en zelfs glycogeenomzet kan reguleren en reguleren. Ketogene stoornis zorgt ervoor dat acetyl-CoA de TCA-flux verhoogt, wat in de lever is gekoppeld aan verhoogde ROS-gemedieerde schade (Satapati et al., 2015; Satapati et al., 2012); dwingt afleiding van koolstof naar de novo gesynthetiseerde lipidesoorten die cytotoxisch zouden kunnen zijn; en voorkomt heroxidatie van NADH tot NAD+ (Cotter et al., 2014) (Fig. 4). Alles bij elkaar genomen, zijn toekomstige experimenten nodig om mechanismen aan te pakken waardoor relatieve ketogene insufficiëntie onaangepast kan worden, kan bijdragen aan hyperglykemie, steatohepatitis kan veroorzaken, en of deze mechanismen werkzaam zijn in menselijke NAFLD/NASH. Aangezien epidemiologisch bewijs een verminderde ketogenese suggereert tijdens de progressie van steatohepatitis (Embade et al., 2016; Marinou et al., 2011; M�nnist� et al., 2015; Pramfalk et al., 2015; Safaei et al., 2016) therapieën die hepatische ketogenese verhogen, kunnen heilzaam zijn (Degirolamo et al., 2016; Honda et al., 2016).
Ketonlichamen en hartfalen (HF)
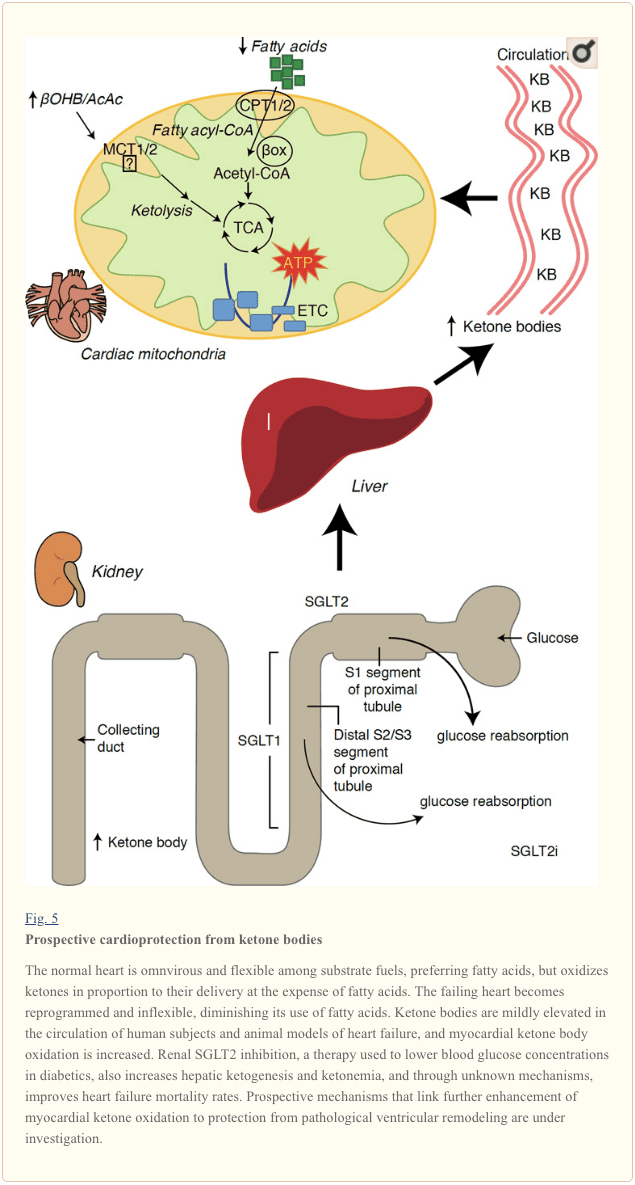
Met een stofwisselingssnelheid van meer dan 400 kcal/kg/dag en een omzet van 6 kg ATP/dag, is het hart het orgaan met het hoogste energieverbruik en de meeste oxidatieve vraag (Ashrafian et al., 35; Wang et al., 2007b). De overgrote meerderheid van de energieomzet van het hart bevindt zich in de mitochondriën en 2010% van deze voorraad is afkomstig van FAO. Het hart is omnivoor en flexibel onder normale omstandigheden, maar het pathologisch hermodellerende hart (bijvoorbeeld als gevolg van hypertensie of myocardinfarct) en het diabetische hart worden elk metabool inflexibel (Balasse en Fery, 70; BING, 1989; Fukao et al., 1954 ; Lopaschuk et al., 2004; Taegtmeyer et al., 2010; Taegtmeyer et al., 1980; Young et al., 2002). Inderdaad, genetisch geprogrammeerde afwijkingen van het hartbrandstofmetabolisme in muismodellen veroorzaken cardiomyopathie (Carley et al., 2002; Neubauer, 2014). Onder fysiologische omstandigheden oxideren normale harten ketonlichamen in verhouding tot hun afgifte, ten koste van vetzuur- en glucoseoxidatie, en myocardium is de grootste ketonlichaamverbruiker per massa-eenheid (BING, 2007; Crawford et al., 1954; GARLAND et al. ., 2009; Hasselbaink et al., 1962; Jeffrey et al., 2003; Pelletier et al., 1995; Tardif et al., 2007; Yan et al., 2001). In vergelijking met vetzuuroxidatie zijn ketonlichamen energetisch efficiënter, waardoor er meer energie beschikbaar is voor ATP-synthese per geïnvesteerd zuurstofmolecuul (P/O-verhouding) (Kashiwaya et al., 2009; Sato et al., 2010; Veech, 1995) . Oxidatie van ketonlichamen levert ook potentieel hogere energie op dan FAO, waardoor ubiquinon geoxideerd blijft, wat de redox-spanwijdte in de elektronentransportketen verhoogt en meer energie beschikbaar maakt om ATP te synthetiseren (Sato et al., 2004; Veech, 1995). Oxidatie van ketonlichamen kan ook de ROS-productie verminderen, en dus oxidatieve stress (Veech, 2004).
Voorlopige interventionele en observationele studies wijzen op een mogelijke heilzame rol van ketonlichamen in het hart. In de experimentele context van ischemie/reperfusieschade verleenden ketonlichamen potentiële cardioprotectieve effecten (Al-Zaid et al., 2007; Wang et al., 2008), mogelijk als gevolg van de toename van mitochondriale overvloed in het hart of opregulatie van cruciale oxidatieve fosforylering bemiddelaars (Snorek et al., 2012; Zou et al., 2002). Recente onderzoeken geven aan dat het gebruik van ketonlichaam wordt verhoogd in falende harten van muizen (Aubert et al., 2016) en mensen (Bedi et al., 2016), wat eerdere observaties bij mensen ondersteunt (BING, 1954; Fukao et al., 2000; Janardhan et al., 2011; Longo et al., 2004; Rudolph en Schinz, 1973; Tildon en Cornblath, 1972). De circulerende ketonlichaamconcentraties zijn verhoogd bij patiënten met hartfalen, in directe verhouding tot de vuldruk, waarnemingen waarvan het mechanisme en de betekenis onbekend blijven (Kupari et al., 1995; Lommi et al., 1996; Lommi et al., 1997; Neely et al. ., 1972), maar muizen met selectieve SCOT-deficiëntie in cardiomyocyten vertonen versnelde pathologische ventriculaire hermodellering en ROS-signaturen als reactie op chirurgisch geïnduceerde schade door drukoverbelasting (Schugar et al., 2014).
Recente intrigerende observaties bij diabetestherapie hebben een mogelijk verband aangetoond tussen myocardiaal ketonmetabolisme en pathologische ventriculaire remodellering (Fig. 5). Remming van de renale proximale tubulaire natrium/glucose-cotransporter 2 (SGLT2i) verhoogt de circulerende ketonlichaamconcentraties bij mensen (Ferrannini et al., 2016a; Inagaki et al., 2015) en muizen (Suzuki et al., 2014) via verhoogde hepatische ketogenese (Ferrannini et al., 2014; Ferrannini et al., 2016a; Katz en Leiter, 2015; Mudaliar et al., 2015). Opvallend is dat ten minste één van deze middelen de HF-hospitalisatie verminderde (bijv. zoals onthuld door de EMPA-REG OUTCOME-studie), en de cardiovasculaire mortaliteit verbeterde (Fitchett et al., 2016; Sonesson et al., 2016; Wu et al., 2016a. ; Zinman et al., 2015). Hoewel de drijvende mechanismen achter gunstige HF-resultaten voor gekoppelde SGLT2i actief worden besproken, is het overlevingsvoordeel waarschijnlijk multifactorieel, prospectief inclusief ketose maar ook heilzame effecten op gewicht, bloeddruk, glucose- en urinezuurniveaus, arteriële stijfheid, het sympathische zenuwstelsel, osmotische diurese / verminderd plasmavolume en verhoogde hematocriet (Raz en Cahn, 2016; Vallon en Thomson, 2016). Samengevat blijft het idee dat therapeutisch toenemende ketonemie, hetzij bij HF-patiënten, of bij patiënten met een hoog risico om HF te ontwikkelen, controversieel, maar wordt actief onderzocht in preklinische en klinische onderzoeken (Ferrannini et al., 2016b; Kolwicz et al., 2016; Lopaschuk en Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
Ketonlichamen in de kankerbiologie
Verbindingen tussen ketonlichamen en kanker komen snel op, maar studies in zowel diermodellen als mensen hebben uiteenlopende conclusies opgeleverd. Omdat ketonmetabolisme dynamisch is en reageert op de voedingstoestand, is het verleidelijk om biologische verbindingen met kanker na te streven vanwege het potentieel voor nauwkeurig geleide voedingstherapieën. Kankercellen ondergaan metabolische herprogrammering om snelle celproliferatie en groei te behouden (DeNicola en Cantley, 2015; Pavlova en Thompson, 2016). Het klassieke Warburg-effect in het metabolisme van kankercellen komt voort uit de dominante rol van glycolyse en melkzuurfermentatie om energie over te dragen en te compenseren voor een lagere afhankelijkheid van oxidatieve fosforylering en beperkte mitochondriale ademhaling (De Feyter et al., 2016; Grabacka et al., 2016; Kang et al., 2015; Poff et al., 2014; Shukla et al., 2014). Glucose-koolstof wordt voornamelijk geleid door glycolyse, de pentosefosfaatroute en lipogenese, die samen zorgen voor tussenproducten die nodig zijn voor de uitbreiding van de tumorbiomassa (Grabacka et al., 2016; Shukla et al., 2014; Yoshii et al., 2015). Aanpassing van kankercellen aan glucosetekort vindt plaats door het vermogen om alternatieve brandstofbronnen te benutten, waaronder acetaat, glutamine en aspartaat (Jaworski et al., 2016; Sullivan et al., 2015). Beperkte toegang tot pyruvaat onthult bijvoorbeeld het vermogen van kankercellen om glutamine om te zetten in acetyl-CoA door carboxylatie, waarbij zowel de energetische als de anabole behoeften behouden blijven (Yang et al., 2014). Een interessante aanpassing van kankercellen is het gebruik van acetaat als brandstof (Comerford et al., 2014; Jaworski et al., 2016; Mashimo et al., 2014; Wright en Simone, 2016; Yoshii et al., 2015). Acetaat is ook een substraat voor lipogenese, wat van cruciaal belang is voor de proliferatie van tumorcellen, en de winst van dit lipogene kanaal wordt geassocieerd met een kortere overleving van de patiënt en een grotere tumorlast (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al. ., 2015).
Niet-kankercellen verplaatsen hun energiebron gemakkelijk van glucose naar ketonlichamen tijdens glucosetekort. Deze plasticiteit kan meer variabel zijn tussen kankerceltypes, maar in vivo geïmplanteerde hersentumoren oxideerden [2,4-13C2]-?OHB in een vergelijkbare mate als omringend hersenweefsel (De Feyter et al., 2016). 'Reverse Warburg-effect' of 'tumormetabolisme met twee compartimenten' veronderstellen dat kankercellen 'OHB-productie induceren in aangrenzende fibroblasten, waardoor wordt voorzien in de energiebehoeften van de tumorcel (Bonuccelli et al., 2010; Martinez-Outschoorn et al., 2012) . In de lever is een verschuiving in hepatocyten van ketogenese naar ketonoxidatie in hepatocellulaire carcinoom (hepatoom) cellen consistent met activering van BDH1- en SCOT-activiteiten waargenomen in twee hepatoomcellijnen (Zhang et al., 1989). Inderdaad, hepatoomcellen brengen OXCT1 en BDH1 tot expressie en oxideren ketonen, maar alleen wanneer serum uitgehongerd is (Huang et al., 2016). Als alternatief is ook ketogenese van tumorcellen voorgesteld. Dynamische verschuivingen in ketogene genexpressie worden vertoond tijdens kankertransformatie van colonepitheel, een celtype dat normaal HMGCS2 tot expressie brengt, en een recent rapport suggereerde dat HMGCS2 een prognostische marker kan zijn van een slechte prognose bij colorectale en plaveiselcelcarcinomen (Camarero et al., 2006; Chen et al., 2016). Of deze associatie ketogenese vereist of impliceert, of een maanlichtfunctie van HMGCS2, moet nog worden bepaald. Omgekeerd, schijnbare ?OHB-productie door melanoom- en glioblastoomcellen, gestimuleerd door de PPAR? agonist fenofibraat, werd geassocieerd met groeistilstand (Grabacka et al., 2016). Verdere studies zijn nodig om de rollen van HMGCS2 / SCOT-expressie, ketogenese en ketonoxidatie in kankercellen te karakteriseren.
Buiten het domein van het brandstofmetabolisme zijn ketonen recentelijk via een signaleringsmechanisme betrokken bij de biologie van kankercellen. Analyse van BRAF-V600E+ melanoom duidde op OCT1-afhankelijke inductie van HMGCL op een oncogene BRAF-afhankelijke manier (Kang et al., 2015). HMGCL-augmentatie was gecorreleerd met een hogere cellulaire AcAc-concentratie, die op zijn beurt de BRAFV600E-MEK1-interactie verbeterde, waardoor de MEK-ERK-signalering werd versterkt in een feed-forward-lus die de proliferatie en groei van tumorcellen stimuleert. Deze observaties roepen de intrigerende vraag op van prospectieve extrahepatische ketogenese die vervolgens een signaleringsmechanisme ondersteunt (zie ook ?OHB als signaleringsmediator en Controverses in extrahepatische ketogenese). Het is ook belangrijk om onafhankelijke effecten van AcAc, d-?OHB en l-?OHB op het metabolisme van kanker in overweging te nemen, en bij het overwegen van HMGCL kan leucinekatabolisme ook gestoord zijn.
De effecten van ketogene diëten (zie ook Therapeutisch gebruik van ketogeen dieet en exogene ketonlichamen) in kankerdiermodellen zijn gevarieerd (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al. ., 2014; Seyfried et al., 2011; Shukla et al., 2014). Terwijl epidemiologische associaties tussen obesitas, kanker en ketogene diëten worden besproken (Liskiewicz et al., 2016; Wright en Simone, 2016), suggereerde een meta-analyse met behulp van ketogene diëten in diermodellen en in studies bij mensen een heilzaam effect op de overleving, met voordelen die prospectief zijn gekoppeld aan de omvang van ketose, het tijdstip van aanvang van het dieet en de locatie van de tumor (Klement et al., 2016; Woolf et al., 2016). Behandeling van pancreaskankercellen met ketonlichamen (d-?OHB of AcAc) remde groei, proliferatie en glycolyse, en een ketogeen dieet (81% kcal vet, 18% eiwit, 1% koolhydraat) verminderde in vivo tumorgewicht, glycemie en verhoogd spier- en lichaamsgewicht bij dieren met geïmplanteerde kanker (Shukla et al., 2014). Vergelijkbare resultaten werden waargenomen met behulp van een gemetastaseerd glioblastoomcelmodel bij muizen die ketonensuppletie in het dieet kregen (Poff et al., 2014). Omgekeerd verhoogde een ketogeen dieet (91% kcal vet, 9% eiwit) de circulerende OHB-concentratie en verminderde glycemie, maar had geen invloed op het tumorvolume of de overlevingsduur bij glioomdragende ratten (De Feyter et al., 2016). Een glucose-ketonindex is voorgesteld als een klinische indicator die de metabole behandeling van door ketogeen dieet geïnduceerde hersenkankertherapie bij mensen en muizen verbetert (Meidenbauer et al., 2015). Alles bij elkaar genomen zijn de rollen van ketonlichaammetabolisme en ketonlichamen in de kankerbiologie verleidelijk omdat ze elk handelbare therapeutische opties bieden, maar fundamentele aspecten moeten nog worden opgehelderd, met duidelijke invloeden die naar voren komen uit een matrix van variabelen, waaronder (i) verschillen tussen exogeen keton lichaam versus ketogeen dieet, (ii) kankerceltype, genomische polymorfismen, graad en stadium; en (iii) timing en duur van blootstelling aan de ketotische toestand.

Ketogenese wordt gecreëerd door ketonlichamen door de afbraak van vetzuren en ketogene aminozuren. Dit biochemische proces levert energie aan verschillende organen, met name de hersenen, onder omstandigheden van vasten als reactie op het niet beschikbaar zijn van bloedglucose. Ketonlichamen worden voornamelijk geproduceerd in de mitochondriën van levercellen. Terwijl andere cellen ketogenese kunnen uitvoeren, zijn ze daar niet zo effectief in als levercellen. Omdat ketogenese plaatsvindt in de mitochondriën, worden de processen onafhankelijk gereguleerd. Dr. Alex Jimenez DC, CCST Insight
Therapeutische toepassing van ketogeen dieet en exogene ketonlichamen
De toepassingen van ketogene diëten en ketonlichamen als therapeutische hulpmiddelen zijn ook ontstaan in niet-kankerachtige contexten, waaronder obesitas en NAFLD/NASH (Browning et al., 2011; Foster et al., 2010; Schugar en Crawford, 2012); hartfalen (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); neurologische en neurodegeneratieve ziekte (Martin et al., 2016; McNally en Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang en Cheng, 2010; Yao et al., 2011); aangeboren stofwisselingsziekten (Scholl-B�rgi et al, 2015); en trainingsprestaties (Cox et al., 2016). De werkzaamheid van ketogene diëten is vooral gewaardeerd bij de behandeling van epileptische aanvallen, met name bij patiënten die resistent zijn tegen geneesmiddelen. De meeste onderzoeken hebben ketogene diëten bij pediatrische patiënten geëvalueerd en laten een vermindering van de aanvalsfrequentie van ~50% zien na 3 maanden, met verbeterde effectiviteit bij bepaalde syndromen (Wu et al., 2016b). De ervaring is beperkter bij volwassen epilepsie, maar een vergelijkbare vermindering is duidelijk, met een betere respons bij symptomatische gegeneraliseerde epilepsiepatiënten (Nei et al., 2014). De onderliggende anticonvulsieve mechanismen blijven onduidelijk, hoewel gepostuleerde hypothesen een verminderd gebruik van glucose/glycolyse, geherprogrammeerd glutamaattransport, indirecte invloed op de ATP-gevoelige kaliumkanaal- of adenosine A1-receptor, wijziging van de isovormexpressie van het natriumkanaal of effecten op circulerende hormonen, waaronder leptine ( Lambrechts et al., 2016; Lin et al., 2017; Lutas en Yellen, 2013). Het blijft onduidelijk of het anti-epileptische effect voornamelijk te wijten is aan ketonlichamen, of aan de cascade metabolische gevolgen van koolhydraatarme diëten. Niettemin lijken ketonesters (zie hieronder) de aanvalsdrempel te verhogen in diermodellen van uitgelokte aanvallen (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
Atkins-stijl en ketogene, koolhydraatarme diëten worden vaak als onaangenaam beschouwd en kunnen constipatie, hyperurikemie, hypocalciëmie, hypomagnesiëmie veroorzaken, leiden tot nefrolithiase, ketoacidose, hyperglykemie veroorzaken en de circulerende cholesterol- en vrije vetzurenconcentraties verhogen (Bisschop et al., 2001 ; Kossoff en Hartman, 2012; Kwiterovich et al., 2003; Suzuki et al., 2002). Om deze redenen vormt langdurige therapietrouw een uitdaging. Knaagdierstudies gebruiken vaak een onderscheidende verdeling van macronutriënten (94% kcal vet, 1% kcal koolhydraat, 5% kcal eiwit, Bio-Serv F3666), die een robuuste ketose veroorzaakt. Echter, het verhogen van het eiwitgehalte, zelfs tot 10% kcal, vermindert de ketose aanzienlijk, en 5% kcal eiwitbeperking geeft verwarrende metabolische en fysiologische effecten. Deze dieetformulering is ook cholinearm, een andere variabele die de gevoeligheid voor leverbeschadiging en zelfs ketogenese beïnvloedt (Garbow et al., 2011; Jornayvaz et al., 2010; Kennedy et al., 2007; Pissios et al., 2013; Schugar et al., 2013). De effecten van langdurige consumptie van ketogene diëten bij muizen blijven onvolledig gedefinieerd, maar recente studies bij muizen lieten een normale overleving en de afwezigheid van markers voor leverbeschadiging zien bij muizen op ketogene diëten gedurende hun hele leven, hoewel aminozuurmetabolisme, energieverbruik en insulinesignalering werden duidelijk opnieuw geprogrammeerd (Douris et al., 2015).
Mechanismen die ketose verhogen door mechanismen die alternatief zijn voor ketogene diëten, omvatten het gebruik van opneembare ketonlichaamprecursoren. Toediening van exogene ketonlichamen zou een unieke fysiologische toestand kunnen creëren die niet wordt aangetroffen in de normale fysiologie, omdat de circulerende glucose- en insulineconcentraties relatief normaal zijn, terwijl cellen de opname en het gebruik van glucose kunnen sparen. Ketonlichamen zelf hebben korte halfwaardetijden en inname of infusie van natrium-OHB-zout om therapeutische ketose te bereiken veroorzaakt een ongewenste natriumbelasting. R/S-1,3-butaandiol is een niet-toxische dialcohol die gemakkelijk in de lever wordt geoxideerd om d/l-?OHB op te leveren (Desrochers et al., 1992). In verschillende experimentele contexten is deze dosis gedurende zeven weken dagelijks aan muizen of ratten toegediend, wat circulerende ?OHB-concentraties opleverde van maximaal 5 mM binnen 2 uur na toediening, die stabiel is gedurende ten minste nog eens 3 uur (D' Agostino et al., 2013). Gedeeltelijke onderdrukking van de voedselinname is waargenomen bij knaagdieren die R/S-1,3-butaandiol kregen (Carpenter en Grossman, 1983). Daarnaast drie chemisch verschillende keton esters (KE's), (i) monoester van R-1,3-butaandiol en d-?OHB (R-3-hydroxybutyl R-?OHB); (ii) glyceryl-tris-?OHB; en (iii) R,S-1,3-butaandiol-acetoacetaat-diester zijn ook uitgebreid bestudeerd (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; Desrochers et al. ., 1995b; Kashiwaya et al., 2010). Een inherent voordeel van de eerste is dat er 2 mol fysiologisch d-?OHB wordt geproduceerd per mol KE, na hydrolyse van esterase in de darm of lever. Veiligheid, farmacokinetiek en tolerantie zijn het meest uitgebreid bestudeerd bij mensen die R-3-hydroxybutyl R-?OHB innamen, in doses tot 714 mg/kg, wat circulerende d-?OHB-concentraties tot 6 mM opleverde (Clarke et al., 2012a; Cox et al., 2016; Kemper et al., 2015; Shivva et al., 2016). Bij knaagdieren verlaagt deze KE de calorie-inname en het totale cholesterolgehalte in het plasma, stimuleert het bruin vetweefsel en verbetert het de insulineresistentie (Kashiwaya et al., 2010; Kemper et al., 2015; Veech, 2013). Recente bevindingen geven aan dat tijdens inspanning bij getrainde atleten de inname van R-3-hydroxybutyl R-?OHB de glycolyse van de skeletspieren en de plasmalactaatconcentraties verminderde, de intramusculaire triacylglyceroloxidatie verhoogde en het spierglycogeengehalte in stand hield, zelfs wanneer gelijktijdige inname van koolhydraten de insulinesecretie stimuleerde ( Cox et al., 2016). Verdere ontwikkeling van deze intrigerende resultaten is vereist, omdat de verbetering van de prestaties van de duurtraining voornamelijk werd veroorzaakt door een robuuste respons op de KE bij 2/8 proefpersonen. Desalniettemin ondersteunen deze resultaten klassieke onderzoeken die wijzen op een voorkeur voor ketonoxidatie boven andere substraten (GARLAND et al., 1962; Hasselbaink et al., 2003; Stanley et al., 2003; Valente-Silva et al., 2015), ook tijdens inspanning, en dat getrainde atleten meer geneigd zijn om ketonen te gebruiken (Johnson et al., 1969a; Johnson en Walton, 1972; Winder et al., 1974; Winder et al., 1975). Ten slotte moeten de mechanismen die verbeterde trainingsprestaties kunnen ondersteunen na gelijke calorie-inname (differentieel verdeeld over macronutriënten) en gelijke zuurstofconsumptie nog worden bepaald.
Toekomstperspectief
Eens grotendeels gestigmatiseerd als een overlooproute die in staat is om giftige emissies van vetverbranding te accumuleren in staten met beperkte koolhydraten (het 'ketotoxische' paradigma), ondersteunen recente waarnemingen het idee dat het ketonlichaammetabolisme een heilzame rol speelt, zelfs in met koolhydraten beladen toestanden. � hypothese. Hoewel de gemakkelijke nutritionele en farmacologische benaderingen om ketonmetabolisme te manipuleren het een aantrekkelijk therapeutisch doelwit maken, blijven agressief geponeerde maar voorzichtige experimenten in zowel de basis- als translationele onderzoekslaboratoria. Er zijn onvervulde behoeften ontstaan op het gebied van het definiëren van de rol van het gebruik van ketonmetabolisme bij hartfalen, obesitas, NAFLD/NASH, diabetes type 2 en kanker. De reikwijdte en impact van 'niet-canonieke' signaleringsrollen van ketonlichamen, inclusief regulatie van PTM's die waarschijnlijk heen en weer terugkoppelen naar metabole en signaalroutes, vereisen een diepere verkenning. Ten slotte zou extrahepatische ketogenese intrigerende paracriene en autocriene signaleringsmechanismen en mogelijkheden kunnen openen om het co-metabolisme in het zenuwstelsel en tumoren te beïnvloeden om therapeutische doeleinden te bereiken.
Dankwoord
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
voetnoten
Concluderend, ketonlichamen worden door de lever aangemaakt om als energiebron te worden gebruikt wanneer er niet genoeg glucose direct beschikbaar is in het menselijk lichaam. Ketogenese treedt op wanneer er lage glucosespiegels in het bloed zijn, vooral nadat andere cellulaire koolhydraatvoorraden zijn uitgeput. Het doel van het bovenstaande artikel was om de multidimensionale rol van ketonlichamen in brandstofmetabolisme, signalering en therapieën te bespreken. De reikwijdte van onze informatie is beperkt tot chiropractische en spinale gezondheidsproblemen. Als u het onderwerp wilt bespreken, kunt u het aan Dr. Jimenez vragen of contact met ons opnemen via�915-850-0900 .
Curator van Dr. Alex Jimenez
Verwezen vanaf: Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Bijkomend onderwerpbespreking: Acute rugpijn
Rugpijn is een van de meest voorkomende oorzaken van arbeidsongeschiktheid en gemiste werkdagen wereldwijd. Rugpijn is de tweede meest voorkomende reden voor doktersbezoeken, alleen overtroffen door bovenste luchtweginfecties. Ongeveer 80 procent van de bevolking zal gedurende zijn leven minstens één keer rugpijn ervaren. De wervelkolom is een complexe structuur die bestaat uit botten, gewrichten, ligamenten en spieren, naast andere zachte weefsels. Letsel en / of verergerde omstandigheden, zoals herniated discs, kan uiteindelijk leiden tot symptomen van rugpijn. Sportblessures of auto-ongelukken zijn vaak de meest voorkomende oorzaak van rugpijn, maar soms kunnen de eenvoudigste bewegingen pijnlijke gevolgen hebben. Gelukkig kunnen alternatieve behandelingsopties, zoals chiropractische zorg, rugpijn helpen verlichten door het gebruik van spinale aanpassingen en handmatige manipulaties, waardoor uiteindelijk de pijnverlichting wordt verbeterd. �

EXTRA EXTRA | BELANGRIJK ONDERWERP: Aanbevolen El Paso, TX Chiropractor
***
Professionele reikwijdte van de praktijk *
De informatie hierin over "Multidimensionale rollen van ketonenlichamen" is niet bedoeld ter vervanging van een een-op-een relatie met een gekwalificeerde zorgverlener of gediplomeerde arts en is geen medisch advies. We moedigen u aan om beslissingen over de gezondheidszorg te nemen op basis van uw onderzoek en samenwerking met een gekwalificeerde zorgverlener.
Blog Informatie & Scope Discussies
Ons informatiebereik: is beperkt tot chiropractie, musculoskeletale, fysieke medicijnen, welzijn, bijdragende etiologische viscerosomatische stoornissen binnen klinische presentaties, geassocieerde somatoviscerale reflex klinische dynamiek, subluxatiecomplexen, gevoelige gezondheidskwesties en/of functionele geneeskunde artikelen, onderwerpen en discussies.
Wij bieden en presenteren klinische samenwerking met specialisten uit verschillende disciplines. Elke specialist wordt beheerst door hun professionele praktijk en hun jurisdictie van licentiestatus. We gebruiken functionele gezondheids- en welzijnsprotocollen om de verwondingen of aandoeningen van het bewegingsapparaat te behandelen en te ondersteunen.
Onze video's, berichten, onderwerpen, onderwerpen en inzichten behandelen klinische zaken, problemen en onderwerpen die verband houden met en direct of indirect onze klinische praktijk ondersteunen.*
Ons kantoor heeft redelijkerwijs geprobeerd om ondersteunende citaten te geven en heeft de relevante onderzoeksstudie of studies geïdentificeerd die onze berichten ondersteunen. Wij verstrekken kopieën van ondersteunende onderzoeksstudies die op verzoek beschikbaar zijn voor regelgevende instanties en het publiek.
We begrijpen dat we zaken behandelen die een aanvullende uitleg vereisen over hoe het kan helpen bij een bepaald zorgplan of behandelprotocol; daarom, om het onderwerp hierboven verder te bespreken, aarzel dan niet om te vragen Dr. Alex Jimenez, DC, of neem contact met ons op 915-850-0900.
Wij zijn er om u en uw gezin te helpen.
zegeningen
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licentie als Doctor of Chiropractic (DC) in Texas & New Mexico*
Texas DC-licentie # TX5807, New Mexico DC-licentie # NM-DC2182
Licentie als geregistreerde verpleegkundige (RN*) in Florida
Florida-licentie RN-licentie # RN9617241 (controle nr. 3558029)
Compacte status: Licentie voor meerdere staten: Geautoriseerd om te oefenen in 40 Staten*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mijn digitale visitekaartje